��Ŀ����
����Ŀ��ij�л���A��ũҩ�����е�һ���м��壬��ṹ��ʽ��ͼ��ʾ�� 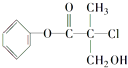
��A�Ľṹ�Ʋ⣬����������ĸ����
a��ʹ������Ȼ�̼��Һ��ɫ
b��ʹ����KMnO4��Һ��ɫ
c����ϡ�����ϼ��ȣ����Է���ȡ����Ӧ
d����Na2CO3��Һ��������CO2
e��1mol A��������NaOH��Һ��Ӧ������������3mol NaOH
f����NaOH����Һ��ϼ��ȣ����Է�����ȥ��Ӧ
g��1mol A��������H2��Ӧ������������4mol H2 ��
���𰸡�bcef
���������⣺�ɽṹ��֪�������к���Cl����OH����COOC����
a�������岻��Ӧ������ʹ������Ȼ�̼��Һ��ɫ���ʴ���
b������OH����ʹ����KMnO4��Һ��ɫ������ȷ��
c������COOC������ϡ�����ϼ��ȣ����Է���ȡ����Ӧ��ˮ�ⷴӦ��������ȷ��
d��������COOH��������Na2CO3��Һ��������CO2 �� �ʴ���
e����Cl����COOC����ˮ�����ɵķө�OH����NaOH��Ӧ����1mol A��������NaOH��Һ��Ӧ������������3mol NaOH������ȷ��
f������Cl����NaOH����Һ��ϼ��ȣ����Է�����ȥ��Ӧ������ȷ��
g��ֻ�б��������������ӳɷ�Ӧ����1mol A��������H2��Ӧ������������3mol H2 �� �ʴ���
���Դ��ǣ�bcef��
�����㾫����������Ĺؼ����������л���Ľṹ�����ʵ����֪ʶ�������л���������ص㣺������ˮ�����������͡��ƾ��������л��ܼ�����Ϊ�ǵ���ʣ������磻�����۷е�ϵͣ�������ȼ�գ��ֽ⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����Ļ������dz��õĻ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1��һ���¶��£���NH4HS������붨��������������ɲ��ַֽ�Ϊ����Ͱ�����NH4HS(s)![]() H2S(g)+NH3(g)
H2S(g)+NH3(g)
�ٿ����ж������ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_____________(ѡ����ĸ)
A�� ![]() B���ܱ���������ѹǿ����
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
����������Ӧ��ƽ��ʱ��p(NH3)��p(H2S)=a(Pa2)����ƽ��ʱ�����е���ѹΪ_______________Pa(�ú�a�Ĵ���ʽ��ʾ)��(p(NH3)��p(H2S)�ֱ����NH3��H2S��ѹǿ��PaΪѹǿ�ĵ�λ)
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ��(��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
��NH4HS�ֽⷴӦ���ʱ���H_________0(�>������=����<��)
��ͼ��������Ӧ������������Ũ����ʱ��仯��ʾ��ͼ����t2ʱ��������Ũ������t3ʱ��Ӧ�ٴδﵽƽ�⣬����ͼ�ϻ���t2ʱ�̺����⡢������Ũ����ʱ��ı仯����.(Ҫ�б�Ҫ��ע)____________

��2��һ���¶��£���Ӧ2SO2+O2![]() 2SO3���ﵽƽ��ʱ��n(SO2):n(O2):n(SO3)=2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2)=0.8mol��n(SO3)=1.4mol����ʱSO2�����ʵ���Ӧ��____________��
2SO3���ﵽƽ��ʱ��n(SO2):n(O2):n(SO3)=2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2)=0.8mol��n(SO3)=1.4mol����ʱSO2�����ʵ���Ӧ��____________��
��3��25��������ҺNa2SO3��Һ������SO2�Ĺ����У�pH��n(SO3- ):n(HSO3��)�仯��ϵ���±�:
n(SO32��):n(HSO3��) | 91��9 | 1��1 | 1��91 |
pH | ��.�� | 7.2 | 6.2 |
�ٵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����:______(ѡ����ĸ)
A��c(Na��)=2c(SO32- )��c(HSO3��)
B��c(Na��)> c(HSO3��)> c(SO32- )>c(H��)=c(OH��)
C��c(Na��)+c(H��)= c(SO32- )+ c(HSO3��)+c(OH��)
��������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ��������д��HSO3- �������ŵ�ĵ缫��Ӧʽ��___________________��

��4����֪��CH��(g)+2O2(g) = CO2 (g) +��H2O (l) ��H= - Q1 kJ/mol
2H2��g��+O2��g�� = ��H2 O ��g�� �� H= - Q2 kJ/mol
2H2��g��+O2��g�� =��H2 O ��l�� �� H= - Q3 kJ/mol,
�����£�ȡ�����4:1�ļ���������Ļ������11.2L(���)������ȫȼ�ջָ����£��ų�����Ϊ_______________________��


