题目内容
将11.5g金属钠投入到足量水中,得到溶液a,将12g镁投入到与水等质量的足量的盐酸中,得到溶液b,则a和b的质量关系为
- A.a=b
- B.a>b
- C.a<b
- D.无法确定
A
分析:根据 2Na+2H2O=2NaOH+H2↑、Mg+2HCl=2NaCl+H2↑,利用差量法来计算.
解答:设金属钠与水反应生成氢气的质量为x,镁与盐酸反应生成氢气的质量为y,则
2Na+2H2O=2NaOH+H2↑
46 2
11.5g x
 ,解得x=0.5g,
,解得x=0.5g,
溶液增重为11.5g-0.5g=11g=a,
Mg+2HCl=2NaCl+H2↑
24 2
12g y
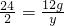 ,解得y=1g,
,解得y=1g,
溶液增重为12g-1g=11g=b,
则a=b,
故选A.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应是解答本题的关键,难度不大.
分析:根据 2Na+2H2O=2NaOH+H2↑、Mg+2HCl=2NaCl+H2↑,利用差量法来计算.
解答:设金属钠与水反应生成氢气的质量为x,镁与盐酸反应生成氢气的质量为y,则
2Na+2H2O=2NaOH+H2↑
46 2
11.5g x
 ,解得x=0.5g,
,解得x=0.5g,溶液增重为11.5g-0.5g=11g=a,
Mg+2HCl=2NaCl+H2↑
24 2
12g y
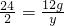 ,解得y=1g,
,解得y=1g,溶液增重为12g-1g=11g=b,
则a=b,
故选A.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
将11.5g金属钠投入到足量的水中,得溶液a;将12g镁投入到与水等质量的足量的盐酸中,得溶液b;则a与b的质量关系为
| A.a=b | B.a>b | C.a<b | D.无法比较 |