题目内容
利用反应Zn+2FeCl3═ZnCl2+2FeCl2设计一个原电池.在右边方格内画出实验装置图,并指出正极为 ,电极反应式为 ;负极为 ,电极反应式为 .
【答案】分析:根据反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式.
解答:解:由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,电解质溶液为FeCl3,实验装置图可设计如下: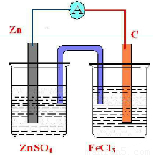 ,
,
故答案为:C;Fe3++e-=Fe2+;Zn;Zn-2e-=Zn2+;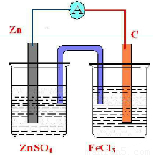 .
.
点评:本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式.
解答:解:由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,电解质溶液为FeCl3,实验装置图可设计如下:
 ,
,故答案为:C;Fe3++e-=Fe2+;Zn;Zn-2e-=Zn2+;
 .
.点评:本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
相关题目
(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: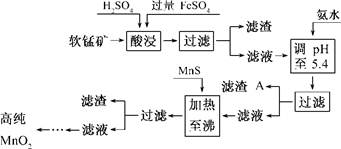
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | pH |
| Al(OH)3 | 5.2 |
| Fe(OH)3 | 3.2 |
| Fe(OH)2 | 9.7 |
| Mn(OH)2 | 10.4 |
| Cu(OH)2 | 6.7 |
| Zn(OH)2 | 8.0 |
| CuS | ≥-0.42 |
| ZnS | ≥2.5 |
| MnS | ≥7 |
| FeS | ≥7 |
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
请回答:
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.

已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.