题目内容
11.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | Mg条插入NaOH溶液中 | 有气泡产生 | Mg可以和NaOH溶液反应 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰无紫色 | 原溶液中无K+ |
| C | 用玻璃棒蘸取氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨水呈碱性 |
| D | CO2通入CaCl2水溶液中 | 溶液变浑浊 | 生成CaCO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.镁与氢氧化钠不反应;
B.用洁净铂丝蘸取溶液进行焰色反应检验钾元素,透过蓝色钴玻璃观察;
C.显碱性的溶液可使红色石蕊试纸变蓝;
D.二氧化碳能与碱溶液氢氧化钙溶液形成碳酸钙沉淀,但却不能与盐溶液氯化钙溶液发生反应.
解答 解:A.只有铝与氢氧化钠反应生成氢气,镁与氢氧化钠不反应,故A错误;
B.火焰呈黄色,说明含有Na+,故B错误;
C.显碱性的溶液可使红色石蕊试纸变蓝,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝说明氨水显碱性,故C正确;
D.二氧化碳不能与氯化钙发生反应,不会产生白色沉淀,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及镁铝的性质、焰色反应、试纸和复分解反应,侧重基础知识的考查,难度中等.

练习册系列答案
相关题目
1.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
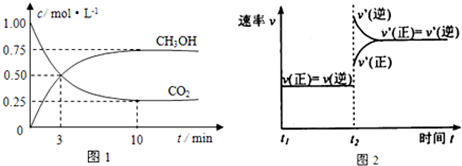
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.

2.下列关于实验安全的说法正确的是( )
| A. | 化学实验室不必备有灭火器等防火器材 | |
| B. | 稀释浓硫酸时要把浓硫酸慢慢注入水中且不断搅拌 | |
| C. | 化学实验室空间较小,易燃易爆物跟其他物质可混存 | |
| D. | 一切能产生有毒气体的实验均不能在实验室中进行 |
19.下列叙述正确的是( )
| A. | 预测PCl3的立体构型为平面三角形 | |
| B. | SO2和CO2都是含有极性键的非极性分子 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | 铝元素的原子核外共有5种不同运动状态的电子 |
3.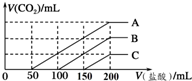 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 通入CO2后,A烧杯中的溶质成分是Na2CO3 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 原NaOH溶液的浓度为0.2 mol/L | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:2 |
20.在常温下,下列可逆反应的平衡移动伴随着颜色变化,但颜色变化不受压强变化影响的是( )
| A. | 2NO2?N2O4 | B. | 2NO2?2NO+O2 | ||
| C. | 2HI?H2+I2 | D. | FeCl3+3KSCN?Fe(SCN)3+3KCl |
1.某无色溶液与NaHCO3 作用能产生气体,此溶液中可能大量共存的离子组是( )
| A. | Na+、Ba2+、NO3-、SO42- | B. | Cl-、K+、H+、SO42- | ||
| C. | Na+、Cl-、K+、Ag+ | D. | Fe2+、SO42-、OH-、Na+ |