��Ŀ����
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ��ͼ��ʾ����Ӧ���������������Ѿ���ȥ����A![]() B
B![]() C
C![]() D
D
��1����A�ǻ�ɫ���壻BΪ����ij���֮һ���ҿ�ʹƷ����Һ��ɫ����Bͨ��KMnO4��Һ������Ϊ�� ������B�� ��������ԡ�����ԭ�ԡ���Ư���ԡ�����
��д��D��Ũ��Һ�뵥��ͭ��Ӧ�Ļ�ѧ����ʽ�� ���˷�Ӧ������������D��μӷ�Ӧ��D�����ʵ���֮��Ϊ�� ��
��2����A�����ʹʪ��ĺ�ɫʯ����ֽ������������D��Ũ��Һ��ʹ����Fe��Al�ۻ���
��д��ʵ�����Ʊ�A�Ļ�ѧ����ʽ�� ��д��C��D�����ӷ���ʽ�� ��
���𰸡���1���Ϻ�ɫ��Ϊ��ɫ����ԭ�ԣ�Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��1��2��
CuSO4+SO2��+2H2O��1��2��
��2��2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O��3NO2+H2O=2H++2NO3��+NO��
CaCl2+2NH3��+2H2O��3NO2+H2O=2H++2NO3��+NO��
��������
���������A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�
��1����A�ǻ�ɫ���壬BΪ����ij���֮һ���ҿ�ʹƷ����Һ��ɫ����BΪSO2��A��S�������ת����ϵ֪��C��SO3��D��H2SO4������������л�ԭ�ԣ���ʹKMnO4��Һ��ɫ��Ũ�����ͭ�ڼ��������������ɶ�������
��2����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ��������A��NH3��D��Ũ��Һ��ʹ����Fe��Al�ۻ�����DΪHNO3�������ת����ϵ֪��B��NO��C��NO2��ʵ�������Ȼ�����������Ƽ����ư������ݴ˴��⣮
�⣺A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�
��1����A�ǻ�ɫ���壬BΪ����ij���֮һ���ҿ�ʹƷ����Һ��ɫ����BΪSO2��A��S�������ת����ϵ֪��C��SO3��D��H2SO4������������л�ԭ�ԣ���Bͨ��KMnO4��Һ������Ϊ���Ϻ�ɫ��Ϊ��ɫ��Ũ�����ͭ�ڼ��������������ɶ�������Ӧ�ķ���ʽΪCu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O����Ӧ������������H2SO4��μӷ�Ӧ��H2SO4�����ʵ���֮��Ϊ1��2��
CuSO4+SO2��+2H2O����Ӧ������������H2SO4��μӷ�Ӧ��H2SO4�����ʵ���֮��Ϊ1��2��
�ʴ�Ϊ���Ϻ�ɫ��Ϊ��ɫ����ԭ�ԣ�Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��1��2��
CuSO4+SO2��+2H2O��1��2��
��2����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ��������A��NH3��D��Ũ��Һ��ʹ����Fe��Al�ۻ�����DΪHNO3�������ת����ϵ֪��B��NO��C��NO2��ʵ�������Ȼ�����������Ƽ����ư�������Ӧ����ʽΪ2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O������������ˮ��Ӧ�������ᣬ��Ӧ�����ӷ���ʽΪ3NO2+H2O=2H++2NO3��+NO��
CaCl2+2NH3��+2H2O������������ˮ��Ӧ�������ᣬ��Ӧ�����ӷ���ʽΪ3NO2+H2O=2H++2NO3��+NO��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O��3NO2+H2O=2H++2NO3��+NO��
CaCl2+2NH3��+2H2O��3NO2+H2O=2H++2NO3��+NO��

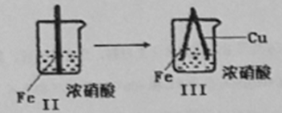
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�����Ŀ����ͨ�����н�������ʵ�飺
���� |
|
| |
���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ���������������ɫ���� |
����˵���в���ȷ����
A��I����������ɫ�����ɫ�Ļ�ѧ����ʽΪ��2NO+O2=2NO2
B��II�е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ
C���Ա�I��II������˵��HNO3��������ǿ��ŨHNO3
D�����III��������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����