题目内容
【题目】化学上常用AG表示溶液中的![]() 。25℃时,用0.100 mol/L 的NaOH溶液滴定20.00 mL 0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100 mol/L 的NaOH溶液滴定20.00 mL 0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是

A. 随着NaOH溶液的加入,![]() 增大
增大
B. 25 ℃时,HNO2的电离常数Ka≈1.0×![]()
C. b点溶液中存在![]()
D. a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
【答案】A
【解析】A、HNO2中加入NaOH发生HNO2+NaOH=NaNO2+H2O,c(H+)减小,c(NO2-)增加,即![]() 随着氢氧化钠的量增加而减小,故A说法错误;B、根据a点进行计算,c(H+)/c(OH-)=10-8.5,根据c(H+)×c(OH-)=Kw,解得c(H+)=10-2.75mol·L-1,根据Ka=
随着氢氧化钠的量增加而减小,故A说法错误;B、根据a点进行计算,c(H+)/c(OH-)=10-8.5,根据c(H+)×c(OH-)=Kw,解得c(H+)=10-2.75mol·L-1,根据Ka=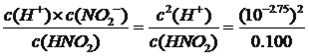 ≈1.0×
≈1.0×![]() ,故B说法正确;C、b点溶液中存在的溶质为等物质的量为HNO2和NaNO2,根据电荷守恒,c(H+)+c(Na+)=c(NO2-)+c(OH-),根据物料守恒,2c(Na+)=c(NO2-)+c(HNO2),联立解得2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故C说法正确;D、HNO2、NaOH抑制水的电离,随着NaOH的量增多,对水的抑制减弱,当HNO2全部转化成NaNO2,即溶质为NaNO2,NO2-发生水解促进水的电离,即水的电离程度最大的是d点,故D说法正确。
,故B说法正确;C、b点溶液中存在的溶质为等物质的量为HNO2和NaNO2,根据电荷守恒,c(H+)+c(Na+)=c(NO2-)+c(OH-),根据物料守恒,2c(Na+)=c(NO2-)+c(HNO2),联立解得2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故C说法正确;D、HNO2、NaOH抑制水的电离,随着NaOH的量增多,对水的抑制减弱,当HNO2全部转化成NaNO2,即溶质为NaNO2,NO2-发生水解促进水的电离,即水的电离程度最大的是d点,故D说法正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目