题目内容
【题目】碘在地壳中主要以NaIO3 , 的形式存在,在海水中主要以I﹣的形式存在,几种粒子之间的转化关系如图所示.下列说法中不正确的是( ) 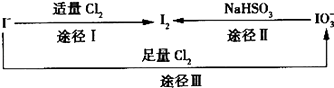
A.用淀粉﹣KI试纸和食醋检验加碘盐时淀粉﹣KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉﹣KI试纸褪色的原因可能是5Cl2+I+6H2O═2HI03+10HCl
C.由图可知氧化性的强弱顺序为Cl>I>IO ![]()
D.途径Ⅱ中若生成1 mol I,则反应中转移的电子数为10NA
【答案】C
【解析】解:A.加碘盐中含有NaIO3 , 其在酸性条件下可被I﹣还原生成I2 , 故用淀粉﹣KI试纸和食醋检验加碘盐时淀粉﹣KI试纸会变蓝,故A正确;B.根据图示转化Ⅲ可知Cl2>NaIO3 , 已变蓝的淀粉﹣KI试纸褪色的原因可能是氯气将碘氧化为HIO3 , 反应方程式为5Cl2+I2+6H2O═2HI03+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2 , 由途径Ⅱ可知氧化性I2<NaIO3 , 由途径Ⅲ可知氧化性Cl2>NaIO3 , 故氧化性的强弱顺序为Cl2>IO3﹣>I2 , 故C错误;
D.根据转化关系2IO3﹣~I2~10e﹣可知,生成1 molI2反应中转移的电子数为10NA , 故D正确;
故选C.
【考点精析】根据题目的已知条件,利用氧化性、还原性强弱的比较的相关知识可以得到问题的答案,需要掌握金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
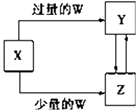
浙江新课程三维目标测评课时特训系列答案【题目】已知X,Y,Z,W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W,X不可能是( )
选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.A
B.B
C.C
D.D