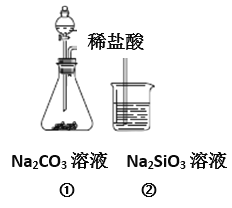
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
周期 族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述元素中具有两性的是(用元素符号表示)_________;写出该种元素的单质与NaOH溶液的方程式 __________________________________________
(2)②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)________________,
(3)写出由以上①④⑤元素构成的化合物的电子式______________________;该化合物含有的化学键类型有___________________________。
(3)用电子式表示⑤元素的单质和⑧元素的单质形成化合物的过程____________________。
【答案】 Al 2Al+2NaOH+2H2O==2NaAlO2+3H2 ↑ H2SiO3 <H2CO3 < HNO3 ![]() 离子键、共价键(或极性共价键)
离子键、共价键(或极性共价键) ![]()
【解析】由元素在周期表中位置可知,①~⑧分别为H、C、N、O、Na、Al、Si、Cl;则(1)上述元素中具有两性的是Al;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,其化学方程式为2Al+2NaOH+2H2O==2NaAlO2+3H2 ↑;(2)同周期元素从左到右非金属性逐渐增强,同主族从上而下非金属性逐渐减弱,非金属性越强,元素对应的最高价氧化物的水化物的酸性越强,故C、N、Si的最高价含氧酸的酸性由弱到强的顺序是H2SiO3 <H2CO3 < HNO3;(3)由H、O、Na元素构成的化合物为NaOH,其电子式为![]() ,氢氧化钠含有离子键和共价键(或极性共价键);(3)一个钠原子失去一个电子,一个氯原子得到一个电子,形成氯化钠,则钠原子和氯原子形成氯化钠的过程表示为:
,氢氧化钠含有离子键和共价键(或极性共价键);(3)一个钠原子失去一个电子,一个氯原子得到一个电子,形成氯化钠,则钠原子和氯原子形成氯化钠的过程表示为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同