题目内容
将Na2O2、NaHCO3组成的混合物分成等质量的两份,向第一份中加入200mL盐酸,充分反应后恰好成中性,放出的气体共4.48L.将此气体通入第二份混合物中,充分反应后,气体体积变为4.032L(均为标准状况).求(1)、加入的盐酸的物质的量浓度.(2)、混合物中Na2O2与NaHCO3的物质的量之比.(写出简要过程)
【答案】分析:根据反应的可能方程式以及气体体积的变化判断反应的可能性,根据二氧化碳是否过量用讨论的方法计算.
解答:解:发生反应的方程式有:
①2Na2O2+4HCl=4NaCl+2H2O+O2
②NaHCO3+HCl=NaCl+H2O+CO2
③2Na2O2+2CO2=2Na2CO3+O2
NaHCO3与盐酸反应产生CO2,Na2O2与盐酸反应生成O2,而CO2与Na2O2反应将产生O2,
故两步反应后的剩余气体一定有O2,可能有CO2,
2.24 L气体的物质的量为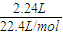 =0.1 mol,
=0.1 mol,
2.016 L气体的物质的量为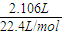 =0.09 mol,
=0.09 mol,
2Na2O2+2CO2=2Na2CO3+O2 △n
0.02mol 0.02mol 0.01mol
n n 0.1mol-0.09mol=0.01mol
n=0.02mol,
1、若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2Na2O2+4HCl=4NaCl+2H2O+O2
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol 0.02mol
消耗的HCl为0.32mol+0.02mol=0.34mol
c(HCl)=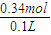 =3.4 mol/L
=3.4 mol/L
混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
2、若CO2未完全反应,则Na2O2应是0.02 mol,
则第一份生成O2的为0.01mol,CO2为0.1mol-0.01mol=0.09mol
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
消耗的HCl为 0.04mol+0.09mol=0.13mol
c(HCl)=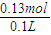 =1.3 mol/L,
=1.3 mol/L,
混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
故答案为:(1)加入的盐酸的物质的量浓度可能为3.4 mol/L或1.3 mol/L;
(2)混合物中Na2O2与NaHCO3的物质的量之比可能为8:1或2:9.
点评:本题考查混合物的计算,题目难度较大,注意用讨论的方法计算.
解答:解:发生反应的方程式有:
①2Na2O2+4HCl=4NaCl+2H2O+O2
②NaHCO3+HCl=NaCl+H2O+CO2
③2Na2O2+2CO2=2Na2CO3+O2
NaHCO3与盐酸反应产生CO2,Na2O2与盐酸反应生成O2,而CO2与Na2O2反应将产生O2,
故两步反应后的剩余气体一定有O2,可能有CO2,
2.24 L气体的物质的量为
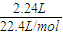 =0.1 mol,
=0.1 mol,2.016 L气体的物质的量为
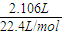 =0.09 mol,
=0.09 mol,2Na2O2+2CO2=2Na2CO3+O2 △n
0.02mol 0.02mol 0.01mol
n n 0.1mol-0.09mol=0.01mol
n=0.02mol,
1、若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2Na2O2+4HCl=4NaCl+2H2O+O2
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol 0.02mol
消耗的HCl为0.32mol+0.02mol=0.34mol
c(HCl)=
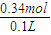 =3.4 mol/L
=3.4 mol/L混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
2、若CO2未完全反应,则Na2O2应是0.02 mol,
则第一份生成O2的为0.01mol,CO2为0.1mol-0.01mol=0.09mol
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
消耗的HCl为 0.04mol+0.09mol=0.13mol
c(HCl)=
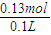 =1.3 mol/L,
=1.3 mol/L,混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
故答案为:(1)加入的盐酸的物质的量浓度可能为3.4 mol/L或1.3 mol/L;
(2)混合物中Na2O2与NaHCO3的物质的量之比可能为8:1或2:9.
点评:本题考查混合物的计算,题目难度较大,注意用讨论的方法计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
|
将Na2O2投入FeCl3溶液中,可观察到的现象是( )
| A、生成白色沉淀 | B、生成红褐色沉淀和有气泡产生 | C、溶液变红 | D、无变化 |