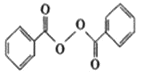
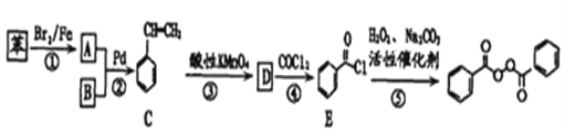
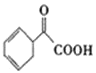
题目内容
【题目】下列说法不正确的是![]()
A.反应速率用于衡量化学反应进行的限度
B.决定反应速率的主要因素是反应物本身的性质
C.放热的反应在常温下不一定都很容易发生
D.放热反应还是吸热反应主要由反应物断键吸收能量与生成物成键放出能量的相对大小决定
【答案】A
【解析】
A.反应速率可衡量反应的快慢,而化学平衡状态用于衡量化学反应进行的限度,故A错误;
B.反应物本身的性质决定反应速率,为决定反应速率的主要因素,故B正确;
C.反应条件与反应吸热、放热无关,则放热的反应在常温下不一定都很容易发生,如氢气燃烧需要点燃,常温不反应,故C正确;
D.化学反应的实质为旧键断裂、新键形成,则一定存在能量变化,所以放热反应还是吸热反应主要由反应物断键吸收能量与生成物成键放出能量的相对大小决定,故D正确;
答案:A。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
【题目】已知反应:2HBr(g)![]() Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.63 | 0.60 | 0.60 | 0.60 | |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是( )
A.从上表数据分析,2HBr(g)![]() Br2(g)+H2(g)正反应为放热反应
Br2(g)+H2(g)正反应为放热反应
B.实验2中HBr的初始浓度C2=1.0 mol/L
C.实验3反应速率小于实验1的反应速率
D.实验4一定使用了催化剂