题目内容
 由硫可制得多硫化钠Na2Sx,x的值一般为2~6.当x=2时,多硫化钠称为过硫化钠.
由硫可制得多硫化钠Na2Sx,x的值一般为2~6.当x=2时,多硫化钠称为过硫化钠.Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式
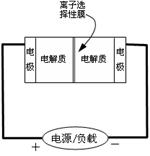
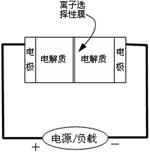
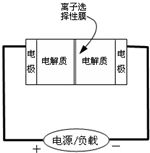
Ⅱ.某些多硫化钠可用于制作蓄电池.如图是一种正在投入生产的大型蓄电系统的原理图.放电充电
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3
| 放电 | 充电 |
(1)电池中的左侧“电极”的电极名称是
(2)放电过程中钠离子从
(3)写出充电过程中阳极的电极反应式
分析:Ⅰ.根据反应物和生成物结合元素化合价的变化书写方程,根据化合价变化判断还原产物;
II.(1)原电池充电时正极与外接电源的正极相连;
(2)放电过程中阳离子向正极移动,阴离子向负极移动;
(3)充电过程中NaBr在阳极失电子发生还原反应,生成NaBr3.
II.(1)原电池充电时正极与外接电源的正极相连;
(2)放电过程中阳离子向正极移动,阴离子向负极移动;
(3)充电过程中NaBr在阳极失电子发生还原反应,生成NaBr3.
解答:解:Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,Na2S2中硫元素为-1价,生成S沉淀为0价,所以还生成硫元素为-2价的H2S,则反应方程式为:Na2S2+2HCl=2NaCl+H2S↑+S↓,Na2S2中硫元素为-1价,降低到-2价,被还原,所以还原产物为H2S;
故答案为:Na2S2+2HCl=2NaCl+H2S↑+S↓;H2S;
II.(1)原电池充电时正极与外接电源的正极相连,所以电池中的左侧“电极”的电极名称是正极,故答案为:正极;
(2)放电过程中阳离子向正极移动,阴离子向负极移动,所以放电过程中钠离子从负极到正极,即从右到左,故答案为:右到左;
(3)充电过程中NaBr在阳极失电子发生还原反应,生成NaBr3,则充电过程中阳极的电极反应式:3NaBr-2e-=NaBr3+2Na+,
故答案为3NaBr-2e-=NaBr3+2Na+.
故答案为:Na2S2+2HCl=2NaCl+H2S↑+S↓;H2S;
II.(1)原电池充电时正极与外接电源的正极相连,所以电池中的左侧“电极”的电极名称是正极,故答案为:正极;
(2)放电过程中阳离子向正极移动,阴离子向负极移动,所以放电过程中钠离子从负极到正极,即从右到左,故答案为:右到左;
(3)充电过程中NaBr在阳极失电子发生还原反应,生成NaBr3,则充电过程中阳极的电极反应式:3NaBr-2e-=NaBr3+2Na+,
故答案为3NaBr-2e-=NaBr3+2Na+.
点评:本题考查了原电池和电解池的工作原理以及电极反应式的书写和离子的流向知识,还涉及了氧化还原,考查角度广,难度较大.

练习册系列答案
相关题目