题目内容
3.已知A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.则(1)元素F在周期表中的位置是第三周期第ⅦA族
(2)六种元素原子半径由小到大的顺序为Na>S>Cl>N>O>H(用元素符号表示)
(3)C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,该物质属于离子化合物(填“离子化合物”或“共价化合物”).
(4)A、C两种元素能形成常温下为液态的两种化合物M和N,具有强氧化性的M的电子式可表示为
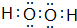 .
.(5)在上述元素最高价氧化物对应的水化物酸性最强的是HClO4(写化学式).
(6)A、B、C、D、E中三种或四种元素能形成多种盐,其中水溶液呈碱性的有Na2SO3、NaClO(至少写两种化合物的化学式)
分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最大的元素,则D为Na元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Na,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C原子最外层有6个电子,原子序数比Na小,则C为O元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最大的元素,则D为Na元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Na,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C原子最外层有6个电子,原子序数比Na小,则C为O元素.
(1)F为Cl元素,在周期表中的位置:第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小,一般电子层越多原子半径越大,故六种元素原子半径由小到大的顺序为:Na>S>Cl>N>O>H,
故答案为:Na>S>Cl>N>O>H;
(3)O元素与Na形成的两种化合物中,其中一种物质含有两种类型的化学键,该物质为过氧化钠,属于离子化合物,故答案为:离子化合物;
(4)H、O两种元素能形成常温下为液态的两种化合物M和N,具有强氧化性的M为H2O2,电子式为 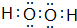 ,故答案为:
,故答案为: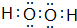 ;
;
(5)在上述元素最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(6)H、N、O、Na、S中三种或四种元素能形成多种盐,其中水溶液呈碱性的有Na2SO3、NaClO等,故答案为:Na2SO3、NaClO.
点评 本题考查结构性质位置关系应用,气体X的水溶液呈碱性是推断元素的突破口,难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 待测液中加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则待测液中一定有硫酸根离子 | |
| B. | 用灼烧的方法可鉴别丝绸与棉布 | |
| C. | 无色溶液中加入Na2CO3溶液产生白色沉淀,则该无色溶液中含有Ca2+ | |
| D. | 待测液中加入AgNO3溶液,有白色沉淀生成,则待测液中含有Cl- |
| 实验 | 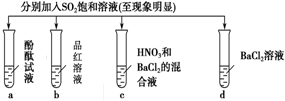 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在共价化合物分子中,一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
| 元素编号 | 元素性质或原子结构 |
| T | 所有元素中电负性最大的元素 |
| X | L层p电子数比s电子数多2个 |
| Y | 其最高价氧化物呈两性 |
| Z | L层有三个未成对电子 |
(2)Z原子共有7种运动状态不同的电子.
(3)写出Z元素形成的单质的结构式:N≡N.
(4)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述 中能证明这一事实的是C
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al(填化学式),理由铝是金属单质,其它的是非金属单质.
(6)T与Z形成的化合物含有的化学键类型共价键.
| A. | BaCl2 | B. | NaHCO3 | C. | Ba(OH)2 | D. | NaOH |