题目内容
(2010?陕西模拟)已知25℃时几种弱酸的电离平衡常数:
|
分析:A、依据溶液中离子积计算氢氧根离子浓度;
B、依据电离常数判断酸性强弱,根据酸性越强,酸根离子水解程度越小;
C、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合.
D、根据溶液的电中性判断;
B、依据电离常数判断酸性强弱,根据酸性越强,酸根离子水解程度越小;
C、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合.
D、根据溶液的电中性判断;
解答:解:A、某浓度HCN的水溶液pH=d,氢离子浓度为10-dmol/L;其中c(OH-)=10-14+d mol/L,故A错误;
B、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故C错误;
D、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,
存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
B、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故C错误;
D、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,
存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
点评:本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意外界条件对电离平衡的影响,利用电荷守恒、质量守恒解答此类题目.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
 Al(OH)3+3H+
Al(OH)3+3H+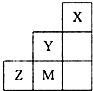 (2010?陕西模拟)图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
(2010?陕西模拟)图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )