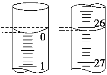
题目内容
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为__________。组成单质C的原子结构示意图__________。
(2)反应①的化学方程式为__________;反应②的化学方程式为__________。
(3)设计实验验证一包纯净物是H_______________。
【答案】(1)Na2O2 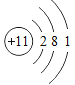 (2分)
(2分)
(2)2Na+2H2O=4NaOH+H2↑、2NaHCO3![]() Na2CO3+H2O+CO2↑(2分)
Na2CO3+H2O+CO2↑(2分)
(3)将灼热的珀丝蘸取H放在酒精灯上灼烧如果产生黄色火焰说明含有钠离子;将H加入氯化钡溶液如果产生白色沉淀,且白色沉淀能溶于稀盐酸产生使澄清石灰水变浑浊的无色无味气体,说明含有碳酸根离子
【解析】
试题分析:常温常压下,B是最常见的无色液体,B是水。A是由单质C在D中燃烧生成的淡黄色固体,D、F、K均为无色无刺激性气味的气体,因此C是Na,D是氧气,A是过氧化钠。过氧化钠和水反应生成氢氧化钠和氧气,钠和水反应生成氢氧化钠和氢气,则F是氢气。根据E、H、I的转化关系可判断K是CO2,H是碳酸钠,I是碳酸氢钠。
(1)过氧化钠的化学式为Na2O2,钠的原子序数是11,原子结构示意图为 。
。
(2)根据以上分析可知反应①、②的化学方程式分别是2Na+2H2O=4NaOH+H2↑、2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(3)要检验H是否是纯净物,需要分别检验阳离子和阴离子,首先利用焰色反应检验钠离子。其次将H加入氯化钡溶液如果产生白色沉淀,且白色沉淀能溶于稀盐酸产生使澄清石灰水变浑浊的无色无味气体,说明含有碳酸根离子。