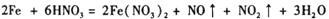��Ŀ����
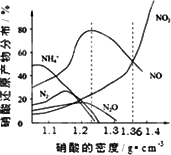
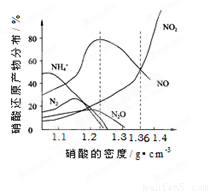
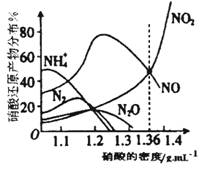
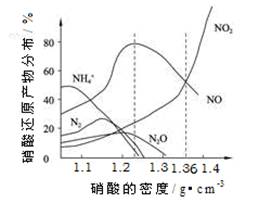
��14�֣���ͼ�Ǹ��ֲ�ͬ�ܶȵ�����������Ӧ(��ͬ�¶�)ʱ��Ҫ��ԭ����ķֲ�ͼ���������ͼ�������ش��й����⡣
��������������ȷ����(�����) ��
A��ͼ�к�������������ܶȣ�������ܶ�Խ����Ũ��Խ��
B������ԭ�����¶���ͬʱ����ͬŨ�ȵ����ᱻ��ԭ�IJ��ﲻ�ǵ�һ�ģ�ֻ����ijŨ��ʱ����ij�ֲ���Ϊ�����ѡ�
C�������Ũ��Խ��ԭ������NԪ�صͻ��ϼ۲���Խ�ࡣ
D���������ܶȴ���1.3 g��cm-3ʱ����ԭ������ҪΪNO��NO2
�� ��������Һ���ܶ�Ϊ1.36 g��cm-3ʱ�����л�ѧ����ʽ�У��ܽ�ȷ����Fe��������ᷴӦ����(����ţ� ��
A��2Fe + 10HNO3 == 2Fe(NO3)3 + NO����3NO2����5H2O
B��4Fe + 18HNO3 == 4Fe(NO3)3 + 3NO����3NO2����9H2O
C��3Fe + 12HNO3 == 2Fe(NO3)3 + Fe(NO3)2 + 2NO����2NO2����3H2O
�� �ܶ�Ϊ1.26 g��cm-3����������Ϊ50.0 %�����ᣬ�����ʵ���Ũ���� mol��L-1��
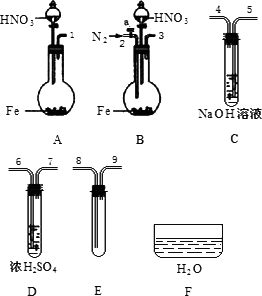
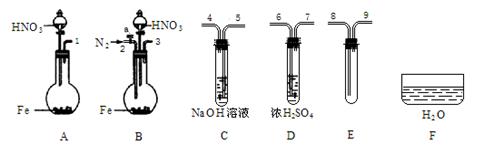
�� ��������������ҩƷ��֤��������1.36 g��cm-3���ᷴӦ�����������к���NO(������N2O4)�����һ����������ʵ�鷽����������ѡ��ʹ�ã�N2�����������ɿ��ƣ�����װ�ú̶�װ��ʡ�ԣ���
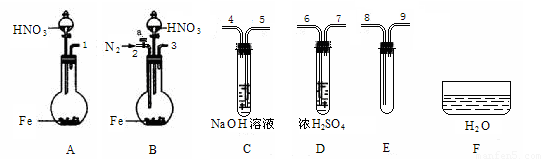
��1������Ӧ���ռ����ɵ����壺
��ʵ�������巢��װ��Ӧѡ�� (��װ�����)�������� ��
��װ�õ�����˳����(���װ�ýӿڵ����)��[ ]��[ ] [ ]��[8] [9]��[ ]��
�ۼ��װ�������Ժ�ʼ��Ӧ����E�г�������ɫ���壬ֹͣʵ�顣
��2������֤E����NO��
�� ȡ���Թ�E��������F�У�����ҡ���Թܡ�
ȷ�����ɵ���������NO�������� ��

����������

| |||||||||||||||||||||||||||||||||||||||