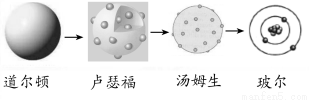
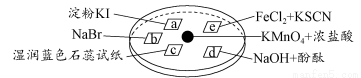
题目内容
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
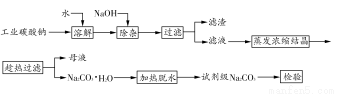
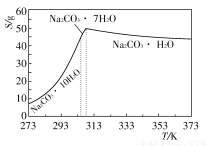
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
(1)Mg(OH)2、Fe(OH)3、CaCO3
(2)防止温度下降时Na2CO3·H2O溶解,避免析出Na2CO3·10H2O或Na2CO3·7H2O
(3)预热过滤装置(或用常压热过滤漏斗进行过滤)
(4)产品纯度降低,因循环使用时母液中Cl-与SO42-累积,导致产品中含有NaCl或Na2SO4等杂质
(5)Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73 kJ/mol
【解析】(1)加入过量的NaOH后,溶液中的Mg2+、Fe3+与OH-反应生成难溶物Mg(OH)2、Fe(OH)3,CO32-与Ca2+反应生成CaCO3,所以滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
(3)保持滤液的温度使过滤过程尽快完成,可以采取的措施有:一是选用热水漏斗(保温漏斗),保温漏斗应先加好热水并预热;二是选用无颈漏斗(或短颈粗玻璃漏斗),可避免样品在颈部析出结晶,影响操作;三是使用折叠滤纸(菊花滤纸),使用折叠滤纸可增大接触面积,有利于热的溶液快速流下,过滤前用少量溶剂润湿滤纸,避免干滤纸在过滤时因吸附溶剂而使晶体析出。
(4)母液中含有NaCl、Na2SO4等杂质,循环使用会降低Na2CO3的纯度。
(5)根据盖斯定律有:1 mol Na2CO3·H2O脱水反应的ΔH=+532.36 kJ/mol-473.63 kJ/mol=+58.73 kJ/mol,再根据热化学方程式的书写原则即可写出Na2CO3·H2O脱水反应的热化学方程式。

温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率大于80%