题目内容
4.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.(1)在如图所示仪器中,配制上述溶液肯定不需要的是AC(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是烧杯、玻璃棒、500mL容量瓶.

(2)在容量瓶的使用方法中,下列操作不正确的是BCD
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL,如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好.
分析 (1)根据配制一定物质的量浓度溶液用到仪器选择;根据配制溶液的体积选择容量瓶的规格;
(2)依据容量瓶构造及正确使用方法解答;
(3)依据m=CVM计算需要溶质的质量;定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析;
(4)据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释前后溶质的物质的量不变计算需要浓硫酸的体积,依此选择合适的量筒.
解答 解:(1)要配置450ml溶液应选择500ml容量瓶,配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧瓶和分液漏斗,还缺少的仪器:烧杯、玻璃棒、500mL容量瓶,
故答案为:AC;烧杯、玻璃棒、500mL容量瓶;
(2)A.在容量瓶的使用方法中,A.使用容量瓶前应该检验是否漏水,故A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.容量瓶为精密仪器,不能在容量瓶中溶解固体,故C错误;
D.容量瓶为精密仪器,不能在容量瓶中稀释浓溶液,故C错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选:BCD;
(3)需要0.1mol/LNaOH溶液450mL,实验室没有450mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏低,小于0.1mol/L;
故答案为:2.0;小于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,应选择15ml量筒;
故答案为:13.6;15.
点评 本题考查一定物质的量浓度溶液的稀释,熟悉配制原理、注意容量瓶、量筒规格的选取方法,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)═X(g)+Y(s) | △H>0 | 它是非自发反应 |
| B | W(s)+xG(g)═20Q(g) | △H<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g)+5Y(g)═4W(g)+6G(g) | 能自发反应 | △H一定小于0 |
| D | 4M(s)+N(g)+2W(l)═4Q(s) | 常温下,自发进行 | △H>0 |
| A. | A | B. | B | C. | C | D. | D |
 已知某温度下:
已知某温度下:反应①:CO2(g)+H2(g)?CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②:
 (g)?
(g)? (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.①、②的化学反应平衡常数分别为K1、K2.
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式CO2(g)+
 (g)?
(g)? (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2.请画出t1之后的正逆反应曲线,并作出标注.
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125mol/L,则2NO2(g)═N2O4(g)的平衡常数K=0.5(写出计算结果);若NO2起始浓度为2mol/L,在相同条件下反应达到平衡时,NO2的转化率为50%.
(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为吸热反应(填“吸热”、“放热”).
②能使该反应的反应速率增大,且平衡向正反应方向移动的是BC.
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO${\;}_{3}^{2-}$ NO${\;}_{3}^{-}$ SO${\;}_{4}^{2-}$ SiO${\;}_{3}^{2-}$ |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液于试管中,加入KSCN溶液后无明显变化.
Ⅲ.另取少量溶液于试管中,加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)甲同学最终确定原溶液中所含阴离子是Cl-、NO3-、SO42-(写离子符号).
(3)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO+2H2O.
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6g.
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2中和 | 化学法 |
(1)某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择②③④(填序号).
①1mL 0.01mol•L-1的碘水 ②1mL 0.001mol•L-1的碘水 ③4mL 0.01mol•L-1的Na2S2O3溶液 ④4mL 0.001mol•L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O${\;}_{3}^{2-}$)=8.33×10-4mol/(L•s).
(3)所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,200℃时,该反应的平衡常数为$\frac{1}{2.25}$,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol
•L-1)变化如表:
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
②CO的平衡转化率为40%.
③若5min~10min只改变了某一条件,该条件是增大水蒸气的浓度,如何改变的增大0.01mol/L.
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A. | △H3=△H1+2△H2 | B. | △H3=△H1+△H2 | C. | △H3=△H1-2△H2 | D. | △H3=△H1-△H2 |
 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.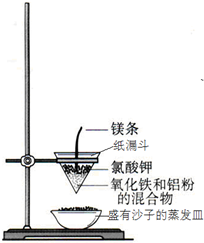 现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.
现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.