题目内容
1.对于有机物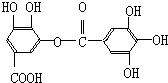 的叙述中不正确的是( )
的叙述中不正确的是( )| A. | 常温下,与Na2CO3溶液反应放出CO2 | |
| B. | 能发生水解反应,1 mol 该有机物能与8 mol 的NaOH反应 | |
| C. | 与稀硫酸共热能生成两种有机物 | |
| D. | 该物质的化学式是C14H10O9 |
分析 该有机物含有-COOH,具有酸性,可发生酯化反应,还有酚羟基,可发生取代、氧化和显色反应,还有酯基,可发生水解,水解生成羧基和酚羟基,以此解答该题.
解答 解:A.分子中含有羧基,具有酸性,可与Na2CO3溶液反应,故A正确;
B.水解产物中共含有6个酚羟基和2个羧基,则1mol该有机物完全反应消耗8molNaOH,故B正确;
C.与稀H2SO4共热,生成一种有机物为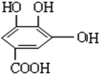 ,故C错误;
,故C错误;
D.由结构简式可知,该有机物的分子式为C14H10O9,故D正确.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、酯性质的考查,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
11.在一定条件下,当64g SO2气体被氧化成SO3气体时,共放出热量98.3kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l)△H=-196.6 kJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-78.64 kJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g)△H=+196.6 kJ•mol-1 |
12.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的 Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有 Ba(NO3)2 的废液倒入水池中,再用水冲入下水道 | |
| C. | 用蒸发方法使 NaCl 从溶液中析出时,应将蒸发皿中 NaCl 溶液全部蒸干才停止加热 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
9.盆栽鲜花一般需施用S-诱抗素制剂,以保证鲜花长期盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )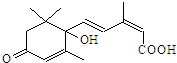

| A. | 该物质的分子式为C15H20O4 | |
| B. | 能发生消去反应 | |
| C. | 既能与FeCl3溶液发生显色反应,又能使溴水褪色 | |
| D. | 1mol该物质与NaOH溶液反应,最多可消耗1mol NaOH溶液 |
16.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.
测得有关数据如表:
下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.
测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
13.下列实验方法正确的是( )
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| C. | 用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 | |
| D. | 用焰色反应鉴别NaCl和KNO3 |
10.下列物质按电解质、非电解质、混合物排序正确的是( )
| A. | 盐酸、硫酸、五水硫酸铜 | B. | NH3、Cu、空气 | ||
| C. | NaOH、SO2、空气 | D. | 氨水、食盐、酒精 |
11.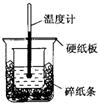 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60 mL 0.50 mol•L-1盐酸跟50 mL 0.55 mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,但是所求中和热相等 |