题目内容
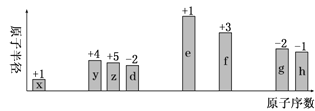
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
根据判断出的元素回答问题:
(1)z在周期表中的位置是_________________________________。
(2)写出x和d组成的一种四原子共价化合物的电子式_______________。
(3)y、g、h的最高价氧化物对应水化物的酸性最强的是______________(填化学式)。
(4)写出f的最高价氧化物与e的最高价氧化物对应的水化物反应的离子方程式______。
(5)已知e和g的最高价氧化物对应的水化物的稀溶液反应生成1mol水时所放出的热量为Q kJ。请写出该反应的中和热的热化学方程式___________。
(6)用y元素的单质与f元素的单质可以制成电极浸入由x、d、e三种元素组成的化合物的溶液中构成电池负极反应式为___________________________________。
【答案】第二周期第VA族![]() HClO4Al2O3+2OH-=2AlO2-+H2ONaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=﹣QkJ·mol﹣1Al-3e-+4OH-=AlO2-+2H2O
HClO4Al2O3+2OH-=2AlO2-+H2ONaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=﹣QkJ·mol﹣1Al-3e-+4OH-=AlO2-+2H2O
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。则
(1)氮元素在周期表中的位置是第二周期第VA族。
(2)H和O组成的一种四原子共价化合物是双氧水,其电子式为![]() 。
。
(3)y、g、h的非金属性强弱是Cl>S>C,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性最强的是HClO4。
(4)f的最高价氧化物氧化铝与e的最高价氧化物对应的水化物氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(5)强酸与强碱在稀溶液中生成1mol水时放出的热量是中和热,已知e和g的最高价氧化物对应的水化物的稀溶液氢氧化钠和稀硫酸反应生成1mol水时所放出的热量为Q kJ,则该反应的中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-QkJ·mol﹣1。
(6)用y元素的单质与f元素的单质可以制成电极浸入由x、d、e三种元素组成的化合物氢氧化钠的溶液中构成电池,由于铝能与氢氧化钠溶液反应,则铝是负极,因此负极反应式为Al-3e-+4OH-=AlO2-+2H2O。

 名校课堂系列答案
名校课堂系列答案