题目内容
纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新材料给予了极大的关注。纳米粒子是指直径为1~100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性能,可开发为新型功能材料,有关纳米粒子的叙述不正确的是( )。
| A.因纳米粒子半径太小,故不能将其制成胶体 |
| B.一定条件下纳米粒子可催化水的分解 |
| C.一定条件下,纳米陶瓷可发生任意弯曲,可塑性好 |
| D.纳米粒子半径小,表面活性高 |
A
解析

练习册系列答案
相关题目
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
金属的下列性质中与金属晶体结构无关的是( )
| A.导电性 | B.化学反应中易失去电子 |
| C.延展性 | D.硬度 |
根据下列性质判断,属于原子晶体的物质是
| A.熔点2 700 ℃,导电性好,延展性强 |
| B.无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂 |
| C.无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电 |
| D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电 |
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是 ( )
| A.该晶体属于原子晶体,其化学键比金刚石中的化学键更牢固 |
| B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 |
在下列四种有关性质的叙述中,可能属于金属晶体的是( )
| A.由分子间作用力结合而成,熔点低 |
| B.固体或熔融后易导电,熔点在1000℃左右 |
| C.由共价键结合成网状结构,熔点高 |
| D.固体不导电,但溶于水或熔融后能导电 |
用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( )。
| A.云母是热的不良导体,传热不均匀 |
| B.石蜡是热的不良导体,传热不均匀 |
| C.石蜡具有各向异性,不同方向导热性能不同 |
| D.云母具有各向异性,不同方向导热性能不同 |
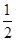 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+