题目内容
19.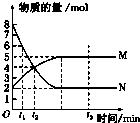 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:(1)t1到t2时刻,以M的浓度变化表示的平均反应速率为$\frac{1}{V({t}_{2}-{t}_{1})}$mol/(L.min).
(2)此反应在该条件下达到限度时,反应物的转化率为75%.
(3)下列叙述中能说明上述反应达到平衡状态的是CEF.
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
G.混合气体的密度不随时间的变化而变化.
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(M);
(2)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,在结合转化率定义计算;
(3)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)由图可知,t1到t2时刻M的物质的量变化为4mol-3mol=1mol,故v(M)=$\frac{\frac{1mol}{VL}}{({t}_{2}-{t}_{1})min}$=$\frac{1}{V({t}_{2}-{t}_{1})}$mol/(L.min),
故答案为:$\frac{1}{V({t}_{2}-{t}_{1})}$mol/(L.min);
(2)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,故N的转化率为$\frac{6mol}{8mol}$×100%=75%,
故答案为:75%;
(3)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,故A错误;
B.混合气体的总质量始终不变,混合气体总质量不变不能说明到达平衡,故B错误;
C.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故C正确;
D.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,不能说明到达平衡,故D错误;
E.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量再不变,说明反应到达平衡,故E正确;
F.N的转化率达到最大,且保持不变,说明可逆反应到达最大限度平衡状态,故F正确;
G.容器体积和其气体质量不变,反应过程中气体的密度始终不变,不能说明反应达到平衡状态,故G错误;
故答案为:CEF.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,难度不大,侧重对基础知识的巩固,注意判断化学平衡状态的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 为了增强高锰酸钾溶液的氧化能力,用稀盐酸将高锰酸钾溶液进行酸化 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 |
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | 2Fe3++H2S═2Fe2++S↓+2H+ | ||
| C. | I2+SO2+2H2O═2I-+SO42-+4H+ | D. | 2Br-+SO42-+4H+═Br2+SO2↑+2H2O |
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
| A. | 羰基硫分子为非极性分子 | |
| B. | 羰基硫的结构式为:O=C=S | |
| C. | 羰基硫沸点比CO2高 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |