题目内容
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
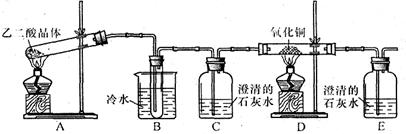
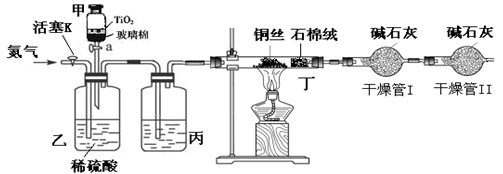
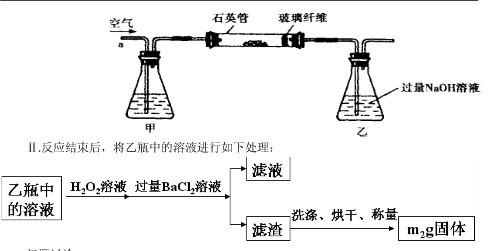
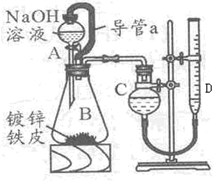
Ⅰ、将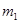 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
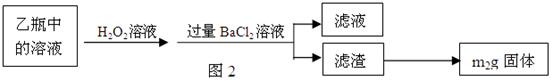
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
[实验二]测定铁元素的含量。
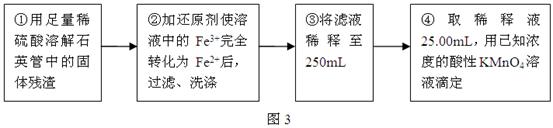
Ⅲ、测定铁元素含量的实验步骤如图3所示:
问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有:
、 。
(2)Ⅱ中的滤渣在称量前还应进行的操作是 。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是 。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 。
写出④中反应的离子方程式 。
(5)该黄铁矿中硫元素的质量分数为 。
[实验一]测定硫元素的含量。
Ⅰ、将
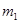 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2 Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。

[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示:

问题讨论:

(1)Ⅰ中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有:
、 。
(2)Ⅱ中的滤渣在称量前还应进行的操作是 。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是 。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 。
写出④中反应的离子方程式 。
(5)该黄铁矿中硫元素的质量分数为 。
(1)NaOH (2分) 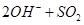 =
=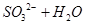 (2分)、
(2分)、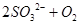 =
=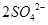 (2分) (2)洗涤、干燥(2分) (3)使
(2分) (2)洗涤、干燥(2分) (3)使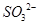 完全转化成
完全转化成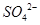 (2分)
(2分)
(4)250ml 容量瓶(2分) 5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O(2分)
(5)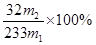 (2分)
(2分)
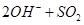 =
=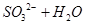 (2分)、
(2分)、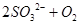 =
=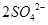 (2分) (2)洗涤、干燥(2分) (3)使
(2分) (2)洗涤、干燥(2分) (3)使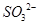 完全转化成
完全转化成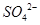 (2分)
(2分)(4)250ml 容量瓶(2分) 5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O(2分)
(5)
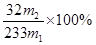 (2分)
(2分)(1)由于空气中含有CO2和水蒸气,所以必须除去,以防止干扰后面的SO2的吸收,因此盛放的是氢氧化钠溶液。SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的方程式是SO2+2OH-=SO32-+H2O。又因为亚硫酸钠极易被氧气氧化,所以还可能发生反应2SO32-+O2=2SO42-。
(2)沉淀在称量之前还需要洗涤和干燥。
(3)为了使溶液中的SO32-完全被氧化生成SO42-,加入的过氧化钠应该是过量的。
(4)由于要稀释至250ml,所以还需要250ml容量瓶。酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,反应的方程式是5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O。
(5)硫酸钡的质量是m2g,物质的量是m2/233mol,则SO2的物质的量是m2/233mol,所以硫元素的质量分数是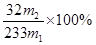 。
。
(2)沉淀在称量之前还需要洗涤和干燥。
(3)为了使溶液中的SO32-完全被氧化生成SO42-,加入的过氧化钠应该是过量的。
(4)由于要稀释至250ml,所以还需要250ml容量瓶。酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,反应的方程式是5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O。
(5)硫酸钡的质量是m2g,物质的量是m2/233mol,则SO2的物质的量是m2/233mol,所以硫元素的质量分数是
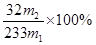 。
。
练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目

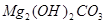 、
、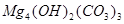 、
、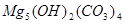 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括