题目内容
3.下列根据实验操作所得出的现象或结论不正确的是| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向苯酚稀溶液中滴加浓溴水 | 酸性明显增强 | 发生了取代反应 |
| B | 向X溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中不一定含有SO${\;}_{4}^{2-}$ |
| C | 向5%H2O2溶液中分别滴入FeCl3、CuSO4溶液 | 前者出现气泡的时间更短 | 催化剂有选择性 |
| D | 向苯酚钠溶液中通入CO2 | 有白色沉淀产生 | 酸性H2CO3>C6H5O H |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯酚中滴加浓溴水生成2,4,6-三溴苯酚沉淀和HBr;
B.不能排除SO32-的影响;
C.滴入FeCl3溶液产生的气泡更快些,说明催化效果好;
D.苯酚钠通入二氧化碳生成苯酚和碳酸氢钠.
解答 解:A.苯酚中滴加浓溴水酸性明显增强,生成HBr,该反应为取代反应,故A正确;
B.若溶液X中含有SO32-,加入稀HNO3,则会被氧化成SO42-,而与Ba2+生成沉淀,故B正确;
C.滴入FeCl3溶液产生的气泡更快些,说明催化效果好,则实验可证明催化剂有选择性,故C正确;
D.苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,是白色浑浊,不是沉淀,故D错误.
故选D.
点评 本题考查较为综合,涉及蛋白质的性质、物质的检验、催化剂以及酸性比较等知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验操作要点,结合物质的性质综合考虑,难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
13.下列叙述正确的是( )
| A. | 氯化铵、次氯酸钠、醋酸铵、硫酸钡都是强电解质 | |
| B. | 电解、电泳、电离、电化学腐蚀均需在通电条件下才能进行 | |
| C. | 红宝石、水晶、钻石的主要成分都是二氧化硅 | |
| D. | 福尔马林、水玻璃、氨水、胆矾均为混合物 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO${\;}_{3}^{-}$=3Fe3++NO↑+4H2O | |
| B. | 向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{加热}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 向NaAlO2溶液中通入过量的CO2:2AlO${\;}_{2}^{-}$+CO2+3H2O=2Al(OH)3↓+CO32- |
8.一般来说,脂溶性的维生素主要积存在人体的( )
| A. | 大脑 | B. | 肌肉 | C. | 血液 | D. | 肝脏 |
15.Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得.己知:
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(3)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01mol、0.01mol、0.01mol、0.01mol.则反应CO2(g)+H2(g)?CO(g)+H2O(g)向逆反应 (填“正反应”或“逆反应”)方向进行,其依据是Qc=$\frac{c(CO)×c(H2O)}{c(CO2)×c(H2)}$=1>0.9=K.
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| T(℃) | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.7 | 2.6 |
12.将Na、A1各2mol投入到同一足量的水中,反应生成气体体积为( )
| A. | 22.4L | B. | 44.8L | C. | 67.2L | D. | 89.6L |
13.化学平衡主要研究下列哪一类反应的规律( )
| A. | 部分反应 | B. | 任何反应 | C. | 可逆反应 | D. | 气体反应 |
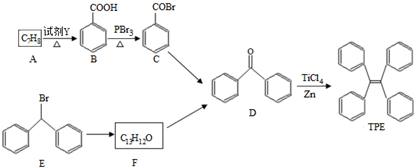
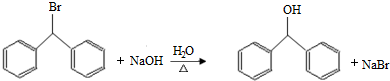 .
.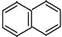 )的一元取代物;
)的一元取代物;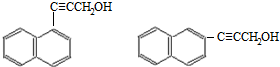 .
.