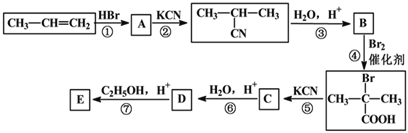
题目内容
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。
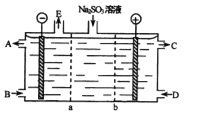
①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
【答案】 三 VA Al(OH)3 24,11,12,8,3,24 P4+3NaOH+3H2O=PH3↑+3NaH2PO2 H3PO2 一 2.5 阳 NaOH溶液 氢气 SO32--2e-+H2O=2H++SO42-
【解析】I.(1)磷元素位于元素周期表第 三周期 VA族;AlP+3H2O=Al(OH)3+PH3,另一种产物的化学式为Al(OH)3 ;(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:应用化合价升降来配,生成1molCu3P降3价,生成1molH3PO4升8价.所以Cu3P系数为8,H3PO4为3.但因为反应物为PH3 ,所以系数*11.最后配水:24CuSO4+11PH3+12H2O═8Cu3P↓+3H3PO4+24H2SO4 ;(3)①黄磷和烧碱溶液反应的化学方程式为P4+3NaOH+3H2O=PH3↑+3NaH2PO2;次磷酸的化学式为H3PO2;从黄磷和过量烧碱溶液反应P4+3NaOH+3H2O=PH3↑+3NaH2PO2,只生成NaH2PO2,如果是三元酸,NaH2PO2中另两个H也被中和,次磷酸属于一元酸;②若起始时有1molP4参加反应,P4+3NaOH+3H2O=PH3↑+3NaH2PO2,生成1molPH3,3molNa3H2PO2,2NaH2PO2+H2SO4=Na2SO4+2H3PO2,3molNa3H2PO2,得3molH3PO2,经反应2H3PO2=H3PO4+PH3,由质量守恒,1.5molPH3,共得2.5molPH3;II.①a表示阳离子交换膜,让Na+ 通过;A-E分别代表生产中的原料或产品,A为浓NaOH溶液,B为稀NaOH溶液,C为硫酸,D、为稀核酸,E为H2。故A表示 NaOH溶液。E表示氢气;②阳极的电极反应式为SO32--2e-+H2O=2H++SO42-。

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案