题目内容
某反应体系中的物质有 ,已知Zn是反应物,下列说法错误的是
,已知Zn是反应物,下列说法错误的是
 ,已知Zn是反应物,下列说法错误的是
,已知Zn是反应物,下列说法错误的是| A.反应中氧化剂与还原剂的物质的量之比为14:5 |
| B.反应中还原剂与氧化产物的物质的量之比为1:1 |
C.若1mol Zn参与反应.则转移的电子数约为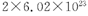 |
D.若把该反应设计成原电池,则负极的电极反应式为 |
A
该反应的方程式为:11Zn + 28HNO3===== 11Zn(NO3)2 + 2NH4NO3 + 2NO + 10H2O;
A错,在该反应中Zn是还原剂,HNO3是氧化剂,其物质的量之比为11:28;
B正确,在该反应中Zn是还原剂,Zn(NO3)2为氧化产物,它们物质的量之比1:1
C正确,若1mol Zn参与反应.则转移的电子数约为:
D正确,在原电池中,负极为失去电子的一极,失去电子后元素的化合价升高,其电极反应式为:Zn—2e—=Zn2+
A错,在该反应中Zn是还原剂,HNO3是氧化剂,其物质的量之比为11:28;
B正确,在该反应中Zn是还原剂,Zn(NO3)2为氧化产物,它们物质的量之比1:1
C正确,若1mol Zn参与反应.则转移的电子数约为:

D正确,在原电池中,负极为失去电子的一极,失去电子后元素的化合价升高,其电极反应式为:Zn—2e—=Zn2+

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 酸中,被氧化的HCl与未被氧化的HCl的质量比为 .
酸中,被氧化的HCl与未被氧化的HCl的质量比为 . 的是
的是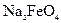 )对河水、湖水消毒是城市饮水处理的新技术。已知反应为:
)对河水、湖水消毒是城市饮水处理的新技术。已知反应为:  ,下列说法正确的是
,下列说法正确的是 既是氧化剂又是还原剂
既是氧化剂又是还原剂 aOH后不变红
aOH后不变红