��Ŀ����
����Ŀ��CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ��H��-867 kJ/mol������Ӧ���������������������Ⱦ����130����180��ʱ���ֱ�0.50mo1CH4��a mol NO2����1L���ܱ������з�����Ӧ������й��������±���
N2(g)+CO2(g)+2H2O(g) ��H��-867 kJ/mol������Ӧ���������������������Ⱦ����130����180��ʱ���ֱ�0.50mo1CH4��a mol NO2����1L���ܱ������з�����Ӧ������й��������±���

��1����չʵ��1��ʵ��2��Ŀ����________________��
��2��180��ʱ����Ӧ��40min����ϵ_____���������������������ﵽƽ��״̬��������______________��CH4��ƽ��ת����Ϊ____________��
��3����֪130��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ6.4 ���Լ���a��ֵ����д��������̣�
��4��һ�������£���Ӧʱ��t��ת������( NO2���Ĺ�ϵ��ͼ��ʾ������ͼ���л���180��ʱ��ѹǿΪP2����ѹǿP2>P1���ı仯���ߣ�������Ҫ�ı�ע��

��5��������֪���㣺��H2=_________��
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ��H1��-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) ��H1��-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ��H2
2N2(g)+CO2(g)+2H2O(g) ��H2
���𰸡���1��̽���¶ȶԷ�Ӧ���ʺͻ�ѧƽ���Ӱ�죻��2���ǣ��¶����߷�Ӧ���ʼӿ죬�����±ȵ����¸���ﵽƽ��״̬���Ա�ʵ��1��ȷ��40minʱ��Ӧ�Ѿ��ﵽƽ��״̬��70%����3��1.2��
��4��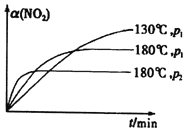 ��
��
��5��-1160kJ/mol��
��������
�����������1��ʵ����ֻ���¶Ȳ�ͬ������ʵ��Ŀ���ǣ��о��¶ȶԸû�ѧƽ���Ӱ�죻��2���Ա�ʵ��1֪��40 minʱ�÷�Ӧ�Ѿ��ﵽƽ��״̬���¶�Խ�ߣ���Ӧ����Խ��Ӧ����ƽ���ʱ��Խ�̣�����40 minʱʵ��2�Ѿ��ﵽƽ��״̬�������ת����=[(0.50.15)mol��0.5mol]��100%=70%����3����������������ʵ���Ϊa��
CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
c0(mol/L)�� 0.5 a 0 0 0
��c(mol/L)��0.40 0.80 0.40 0.40 0.80
cƽ(mol/L)��0.10 a-0.80 0.40 0.40 0.80
��[0.40��0.40��(0.80) 2]��[0.10��(a0.80)]= 6.4�����a=1.2mol��
��4����ͬ�¶��£�ѹǿԽ��Ӧ����Խ��Ӧ����ƽ���ʱ��Խ�̣�����ѹǿ����ѧƽ�������������С���淴Ӧ�����ƶ���ʹ����������ת����ԽС����ͬѹǿ�£��¶�Խ�߷�Ӧ����Խ��Ӧ����ƽ���ʱ��Խ�̣�����������ת����ԽС��������Ӧͼ��ɱ�ʾΪ��
 ��
��
��5����CH4(g)+4NO2(g) ![]() 4NO(g)+CO2(g)+2H2O(g) ��H1��-574kJ/mol��
4NO(g)+CO2(g)+2H2O(g) ��H1��-574kJ/mol��
��CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ��H��-867 kJ/mol��
N2(g)+CO2(g)+2H2O(g) ��H��-867 kJ/mol��
������ʽ�ڡ�2-�ٵ�CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)
2N2(g)+CO2(g)+2H2O(g)
��H2=(-867kJ/mol)��2-(-574kJ/mol)=-1160KJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�