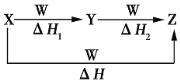
题目内容
【题目】现有一瓶1 000 mL、含25% NaClO、密度是1.19 g.cm-3的“84消毒液”,使用时需要稀释100倍(体积比),密封保存。下列分析不正确的是
A. 该“84消毒液”中NaClO物质的量浓度为4.0 mol·L-l
B. 该“84消毒液”稀释100倍后,Na+的物质的量浓度为0. 04 mol·L-l
C. 空气中的CO2与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O= NaHCO3+ HClO
D. 用容量瓶配制上述浓度的“84消毒液”480 mL,需要称量的NaClO固体质量为143.0 g
【答案】D
【解析】
A.c(NaClO)=![]() =
=![]() =4.0 molL-1,来计算;B.稀释前后物质的量不变,体积变为原来的100倍,则浓度变为原来的
=4.0 molL-1,来计算;B.稀释前后物质的量不变,体积变为原来的100倍,则浓度变为原来的![]() ,即稀释后浓度为0.04 mol.L-l,故B正确;C.酸性:H2CO3>HClO>HCO3-,由强酸制弱酸原理可知,C02与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O═NaHCO3+HC1O,故C正确;D.配制480 ml溶液需要500mL的容量瓶,由n=cV=4mol/L×0.5L=2mol,则m=nM=2mol×74.5g/mol=149g,故D错误;故选D。
,即稀释后浓度为0.04 mol.L-l,故B正确;C.酸性:H2CO3>HClO>HCO3-,由强酸制弱酸原理可知,C02与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O═NaHCO3+HC1O,故C正确;D.配制480 ml溶液需要500mL的容量瓶,由n=cV=4mol/L×0.5L=2mol,则m=nM=2mol×74.5g/mol=149g,故D错误;故选D。

练习册系列答案
相关题目