题目内容
(2011?枣庄模拟)工业上合成氨在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g)△H=-92.44kJ/mol.其部分工艺流程如图1所示:
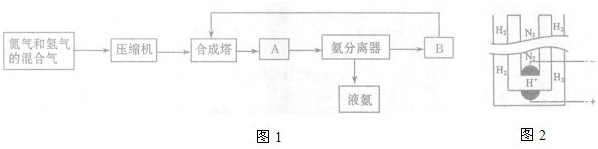
(1)合成氨所需要的原料气中,氮气取自
(2)对原料气进行净化处理的目的是
(3)设备A的名称是
(4)在20~50Mpa时,工业合成氨选择在400-500℃的温度进行反应,主要原因是
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池(如图2)中,氢和氮在电极上合成了氨,且转化率达到了78%.则:阳极反应为

(1)合成氨所需要的原料气中,氮气取自
空气
空气
,氢气来源于水和碳氢化合物
水和碳氢化合物
.(2)对原料气进行净化处理的目的是
防止催化剂中毒
防止催化剂中毒
.(3)设备A的名称是
冷凝器
冷凝器
,设备B的名称是循环压缩机
循环压缩机
.(4)在20~50Mpa时,工业合成氨选择在400-500℃的温度进行反应,主要原因是
此温度下催化剂的活性大
此温度下催化剂的活性大
.(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池(如图2)中,氢和氮在电极上合成了氨,且转化率达到了78%.则:阳极反应为
H2-2e-═2H+
H2-2e-═2H+
,阴极反应为N2+6e-+6H+═2NH3
N2+6e-+6H+═2NH3
.分析:(1)根据工业生产中,氮气和氢气的来源来回答;
(2)工业上在合成氨的过程中,为防止催化剂中毒,必须对原料进行净化;
(3)根据合成氨的设备来回答;
(4)合成氨的过程并必须选择适宜的温度,保障反应速率和限度较大;
(5)在电解池中,阳极发生失电子的氧化反应,阴极发生得电子的还原反应.
(2)工业上在合成氨的过程中,为防止催化剂中毒,必须对原料进行净化;
(3)根据合成氨的设备来回答;
(4)合成氨的过程并必须选择适宜的温度,保障反应速率和限度较大;
(5)在电解池中,阳极发生失电子的氧化反应,阴极发生得电子的还原反应.
解答:解:(1)根据工业生产中,氮气来自空气,氢气来自水和碳氢化合物,故答案为:空气;水和碳氢化合物;
(2)工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,故答案为:防止催化剂中毒;
(3)合成氨的设备依次有:压缩机、合成塔、冷凝器、氨分离器、循环压缩机,故答案为:冷凝器;循环压缩机;
(4)合成氨的过程中,为保障反应速率和限度较大、催化剂的活性大,要选择适宜的温度400-500℃,故答案为:此温度下催化剂的活性大;
(5)氢和氮在电极上合成了氨的电解池中,阳极是氢气发生失电子的氧化反应,即H2-2e-═H2↑,阴极是氮气发生得电子的还原反应,即N2+6e-+6H+═2NH3,故答案为:H2-2e-═2H+;N2+6e-+6H+═2NH3.
(2)工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,故答案为:防止催化剂中毒;
(3)合成氨的设备依次有:压缩机、合成塔、冷凝器、氨分离器、循环压缩机,故答案为:冷凝器;循环压缩机;
(4)合成氨的过程中,为保障反应速率和限度较大、催化剂的活性大,要选择适宜的温度400-500℃,故答案为:此温度下催化剂的活性大;
(5)氢和氮在电极上合成了氨的电解池中,阳极是氢气发生失电子的氧化反应,即H2-2e-═H2↑,阴极是氮气发生得电子的还原反应,即N2+6e-+6H+═2NH3,故答案为:H2-2e-═2H+;N2+6e-+6H+═2NH3.
点评:本题是一道化学和工业生产联系的题目,要求学生熟记工业合成氨的设备以及原料的选择来源方面的知识,难度较大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 2SO3(g)△H=-196.6KJ?mol- 1)
2SO3(g)△H=-196.6KJ?mol- 1)