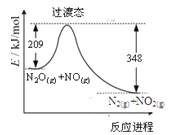
题目内容
【题目】在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
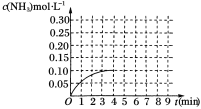
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
【答案】(1)0.025(2)AC(3)59.26(4)向正反应方向、不变
(5)
【解析】
试题解析:(1)由图可知,4min达平衡,△c(NH3)=0.1mol/L,v(NH3)=![]() =0.025mol/(Lmin);
=0.025mol/(Lmin);
(2)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L,但是,改变温度平衡一定移动,NH3的物质的量浓度也不可能为0.1mol/L,答案选AC;
(3) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L)0.1 0.3 0
转化浓度(mol/L)0.05 0.15 0.1
平衡浓度(mol/L)0.05 0.15 0.1
平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,则K=![]() =
=![]() =59.26;由N2(g)+3H2(g)
=59.26;由N2(g)+3H2(g)![]() 2NH3(g)可知,生成氨气0.2mol时参加反应的氢气为0.3mol,所以氢气的转化率为
2NH3(g)可知,生成氨气0.2mol时参加反应的氢气为0.3mol,所以氢气的转化率为![]() ×100%=50%;
×100%=50%;
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,压强增大,平衡向正反应方向移动,化学平衡常数只与温度有关系,温度不变,平衡常数不变;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25molL-1,则图像为:
 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案