题目内容
把x mL CO2通过足量的Na2O2后再与y mL NO混合。x与y之和为30。设充分反应后气体的体积缩小为15 mL(不考虑NO2转化为N2O4),则x:y可能为
①1:1 ②2:1 ③3:4 ④7:5 ⑤1:2 ⑥任意比
| A.① | B.①④⑤⑥ | C.①②④ | D.①③④⑤ |
C
解析试题分析:根据反应的方程式2Na2O2+2CO2=2NaCO3+O2可知,生成氧气的体积是x/2ml。氧气和NO反应的方程式是2NO+O2=2NO2,由于充分反应后气体的体积缩小为15 mL,所以如果氧气过量或恰好反应,即y≤x时,则y+x/2-y/2=15,解得x+y=30,所以只要x≥y,是恒成立的;如果x<y,则NO过量,此时y-x+x=15,解得x=y=15,不成立,因此正确的答案选C。
考点:考查根据方程式进行的有关计算
点评:该题计算的关键是根据反应的方程式,分别进行讨论逐一分析。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 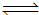 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)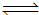 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)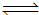 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)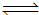 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。


图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O; 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;