题目内容
为了在实验室利用工业原料制备少量氨气,有人设计了如图所示装置(图中夹持装置均已略去).
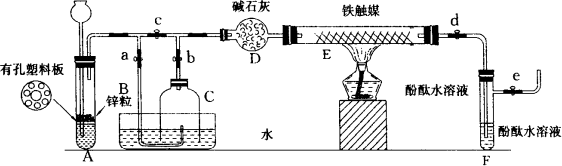
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e,在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,打开弹簧夹c、d、e,则A中有氢气产生,在F出口处收集氢气并检验其纯度.
②关闭弹簧夹c取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示,氢气继续在瓶内燃烧,几分钟后火焰熄灭.
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红.
回答下列问题:
(1)检验氢气纯度的目的是________.
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是________,防止实验装置中压强过大.此时再打开弹簧夹b的原因是________,C瓶内气体的成分是________.
(3)在步骤③中,先加热铁触媒的原因是________.反应管E中发生反应的化学方程式是________.
解析:
|
答案:(1)通过检验H2的纯度证明E管中空气被排尽,同时也防止点燃氢气时发生爆炸 (2)A装置中液面下降,酸液与锌粒脱离,反应停止;使C瓶内气体进入E管中;N2、H2、少量的CO2和水蒸气 (3)合成氨反应需在高温下进行,故需先加热铁触媒; 解析:(1)在该实验中,关闭弹簧夹a、b,打开弹簧夹c、d、e,H2可以进入E装置,排尽其中的空气,防止空气中的O2将E装置中的铁触媒氧化,通过检验H2的纯度可以证明E装置中空气是否被排尽,同时在②步实验中要点燃H2,在点燃之前,也必须检验其纯度,防止爆炸. (2)C瓶内水位下降,说明瓶内压强大于外界压强,会导致A装置中长颈漏斗内液面上升,试管内液面下降,使酸液与Zn粒相脱离,停止反应.此时打开弹簧夹b,H2和N2混合气体在较大的压强作用下会通过导气管,经干燥管进入E管.由于空气中的O2与H2反应了,所以C瓶内气体的成分是N2、H2及少量的CO2和水蒸气. (3)N2与H2需在高温下才能反应生成NH3,故需先加热铁触媒.反应的化学方程式为:N2+3H2 |

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案



