题目内容
某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05mol?L-1的金属氯化物(RClx) 溶液20mL,使之恰好与20mL 0.15mol?L-1的AgNO3溶液完全反应.则该氯化物的化学式为
- A.RCl
- B.RCl2
- C.RCl3
- D.RCl4
C
分析:根据反应Ag++Cl-=AgCl↓可计算Cl-的物质的量,根据x=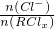 计算x的值,进而计算化学式.
计算x的值,进而计算化学式.
解答:n(Ag+)=0.02L×0.15mol/L=0.003mol,
Ag++Cl-=AgCl↓
1 1
0.003mol n(Cl-)
n(Cl-)=0.003mol,
又n(RClx)=0.02L×0.05mol=0.001mol,
则x=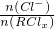 =
=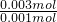 =3,
=3,
所以化学式为RCl3,
故选C.
点评:本题考查离子方程式的计算,题目难度不大,本题注意根据x=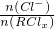 计算x的值.
计算x的值.
分析:根据反应Ag++Cl-=AgCl↓可计算Cl-的物质的量,根据x=
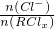 计算x的值,进而计算化学式.
计算x的值,进而计算化学式.解答:n(Ag+)=0.02L×0.15mol/L=0.003mol,
Ag++Cl-=AgCl↓
1 1
0.003mol n(Cl-)
n(Cl-)=0.003mol,
又n(RClx)=0.02L×0.05mol=0.001mol,
则x=
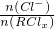 =
=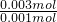 =3,
=3,所以化学式为RCl3,
故选C.
点评:本题考查离子方程式的计算,题目难度不大,本题注意根据x=
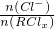 计算x的值.
计算x的值. 
练习册系列答案
相关题目