题目内容
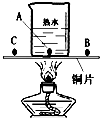 根据下列数据及实验装置图(所有夹持仪器均省略),回答下列问题:
根据下列数据及实验装置图(所有夹持仪器均省略),回答下列问题:| 物质 | 着火点 | 酒精灯的火焰温度 |
| 白磷 | 40℃ | 500℃ |
| 红磷 | 240℃ |
(2)将一支装满氧气的试管倒扣在(1)中“一定不会燃烧”的物质上面,现象是
(3)烧杯中热水的作用
(4)由此得出燃烧的条件是
分析:(1)据题意可知C、B点上的可燃物都与空气(氧气)接触,C点是白磷所以先燃烧.A点不与氧气接触,不会燃烧;
(2)白磷只有与氧气接触后才燃烧并有白烟冒出;
(3)热水的作用是提高温度且隔绝氧气;
(4)燃烧需要同时满足三个条件:①可燃物;②与氧气或空气接触; ③达到燃烧所需的最低温度即着火点.
(2)白磷只有与氧气接触后才燃烧并有白烟冒出;
(3)热水的作用是提高温度且隔绝氧气;
(4)燃烧需要同时满足三个条件:①可燃物;②与氧气或空气接触; ③达到燃烧所需的最低温度即着火点.
解答:解:(1)可燃物燃烧的条件是①达到着火点.②与氧气接触.图中C是白磷着火点低于B点的红磷,所以C先燃烧.A没与氧气接触,故不燃烧,故答案为:C;A;
(2)接触试管内的氧气燃烧,生成五氧化二磷冒出白烟.燃烧消耗试管内的氧气,压强变小,试管内的液面不断上升,
故答案为:白磷浮在水面上燃烧、冒白烟、试管内的液面不断上升;4 P+5O2
2P2O5;
(3)热水的作用是提高温度且隔绝氧气,故答案为:提高温度且隔绝氧气;
(4)由题意可知,水中的白磷没有与氧气接触,故不能燃烧;铜片上的红磷没有达到着火点,故也不能燃烧;只有铜片上的白磷既和氧气接触,又达到了着火点,所以燃烧.因此可燃物燃烧的条件是:与氧气接触;达到自身的着火点.
故答案为:①可燃物;②与氧气或空气接触; ③达到燃烧所需的最低温度即着火点.
(2)接触试管内的氧气燃烧,生成五氧化二磷冒出白烟.燃烧消耗试管内的氧气,压强变小,试管内的液面不断上升,
故答案为:白磷浮在水面上燃烧、冒白烟、试管内的液面不断上升;4 P+5O2
| ||
(3)热水的作用是提高温度且隔绝氧气,故答案为:提高温度且隔绝氧气;
(4)由题意可知,水中的白磷没有与氧气接触,故不能燃烧;铜片上的红磷没有达到着火点,故也不能燃烧;只有铜片上的白磷既和氧气接触,又达到了着火点,所以燃烧.因此可燃物燃烧的条件是:与氧气接触;达到自身的着火点.
故答案为:①可燃物;②与氧气或空气接触; ③达到燃烧所需的最低温度即着火点.
点评:本题以试验探究的形式考查了物质燃烧需要的条件,以及磷燃烧时的现象生成物和压强的大小.培养了学生的动手能力.

练习册系列答案
相关题目
利用如图1所示实验装置可以测定一条条件下1mol气体的体积,图1中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.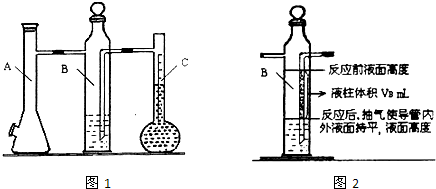
实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格.
(2)B中所装液体一般是 (填“水”或“品红”).A中发生反应的离子方程式为 .
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
①上表中X= .
②计算1mol氢气体积两次实验的平均值= L.
③计算实验误差:(实验值-理论值)/理论值×100%= .
④引起该误关的可能原因 (填字母).
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是 (合理则填序号,否则填“无”).如有合理之处,请根据下面的数据给出修正的1mol氢气体积的数学表达式.(镁元素的相对原子质量为24.3)
1mol氢气体积= L(填写数学表达式).

实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
(2)B中所装液体一般是
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
②计算1mol氢气体积两次实验的平均值=
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
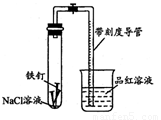
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
(1)实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生.用H2SO4溶液浸泡的目 的是______.
(2)为尽量减小误差,下列操作的正确顺序是______(填序号).
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为______;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②______.
(4)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH
假设二: NaCl溶液的浓度______
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
| pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
| 液柱高度 | 0cm | 1.3cm | 8.5cm | 8.4cm | 8.5cm | 8.5cm |
| 形成稳定液柱时间 | 3.0min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | 17.5 min |
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二.
第一步:______;
第二步:______,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论.
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.