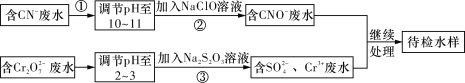
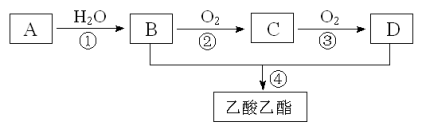
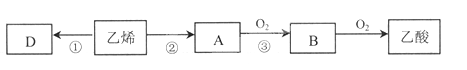
题目内容
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g。下列有关叙述中不正确的是( )
A. 原混合物中CuO和Fe2O3的物质的量的比为1:1
B. 参加反应的CO的质量为11.2g
C. 原混合物中Fe元素的质量为5.6g
D. 原混合物中CuO的质量分数约为33.3%
【答案】C
【解析】试题分析:反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g为碳酸钙质量,碳酸钙的物质的量为![]() =0.4mol,根据碳原子守恒,所以反应后所得CO2的物质的量为为0.04mol。一个CO获得1个氧原子生成CO2,根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol。
=0.4mol,根据碳原子守恒,所以反应后所得CO2的物质的量为为0.04mol。一个CO获得1个氧原子生成CO2,根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol。
令CuO、Fe2O3的物质的量分别为x、y,则①x+3y=0.4mol②x×80g/mol+y×160g/mol=24g解得:x=0.1mol,y=0.1mol。A.由上述计算可知,原混合物中CuO与Fe2O3物质的量比为0.1mol:0.1mol=1:1,故A正确;B.实验过程中参加反应的CO质量为0.4mol×28g/mol=11.2g,故B正确;C.根据上述分析可知Fe2O3的物质的量为0.1mol,则铁元素的物质的量为0.2mol,所以原混合物中Fe元素的质量为11.2g,故C错误;D.由上述计算可知,原混合物中CuO与Fe2O3物质的量比为0.1mol:0.1mol=1:1,所以原混合物中CuO与Fe2O3的质量比为80:160=1:2,即原混合物中CuO的质量分数约为33.3%,故D正确。故选C。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
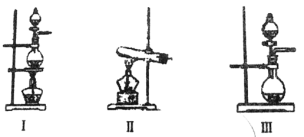
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?
【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 60℃ |
B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |