题目内容
18.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 在恒温恒容下,当容器中压强不再变化时,该反应达到了化学平衡状态 | |
| B. | 已知c(CO2)•c(H2)=c(CO)•c(H2O),则温度为800℃ | |
| C. | 该反应的△H>0 | |
| D. | 在830℃时,发生上述反应,达到平衡时CO2的转化率为50% |
分析 A.反应前后气体物质的量不变,恒温恒容下,容器内压强始终不变;
B.已知c(CO2)•c(H2)=c(CO)•c(H2O),则平衡常数K=1;
C.由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应;
D.温度为830℃时平衡常数K=1,则c(CO2)•c(H2)=c(CO)•c(H2O),不能说明c(CO2)=c(CO).
解答 解:A.反应前后气体物质的量不变,恒温恒容下,容器内压强始终不变,容器中压强不再变化,不能说明该反应达到了化学平衡状态,故A错误;
B.已知c(CO2)•c(H2)=c(CO)•c(H2O),则平衡常数K=1,则温度为在830℃,故B错误;
C.由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应,则△H>0,故C正确;
D.温度为830℃时平衡常数K=1,则c(CO2)•c(H2)=c(CO)•c(H2O),不能说明c(CO2)=c(CO),平衡时CO2的转化率不一定为50%,故D错误,
故选:C.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、平衡常数,难度不大,注意对平衡常数的理解,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
20.在限定条件下,下列溶液中各组离子一定能大量共存的是( )
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 与Al能产生氢气的溶液:K+、SO42-、HCO3-、NH4+ | |
| C. | 碳酸氢钠溶液:K+、Na+、Cl-、SO42- | |
| D. | 常温下pH<7的溶液:K+、SiO32-、Na+、AlO2- |
9.某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=$\frac{9}{4}$.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.
下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| B. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 平衡时,甲中和丙中H2的转化率均是60% |
6.某无色透明溶液能与铝粉反应放出H2,则此溶液中可能存在( )
| A. | OH-、Ba2+、Cl-、Na+ | B. | H+、Cl-、Na+、SO${\;}_{4}^{2-}$ | ||
| C. | H+、Cu2+、[Al(OH)4]-、SO${\;}_{4}^{2-}$ | D. | H+、Ba2+、Mg2+、NO${\;}_{3}^{-}$ |
13.下列说法正确的是( )
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 蛋白质在一定条件发生水解反应生成葡萄糖 | |
| C. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程 | |
| D. | 食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 |
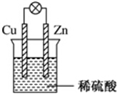 如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.
如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.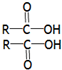 $→_{△}^{浓H_{2}SO4}$
$→_{△}^{浓H_{2}SO4}$
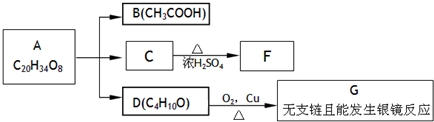
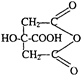
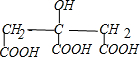 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$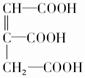 +H2O
+H2O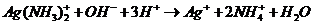
 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$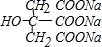 +CH3COONa+4H2O+4CH3CH2CH2CH2OH.
+CH3COONa+4H2O+4CH3CH2CH2CH2OH.