题目内容
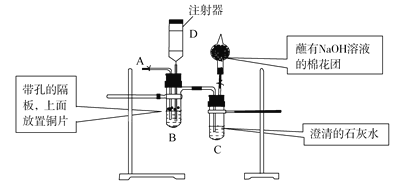
【题目】下图为实验室制取氯气及探究Cl2性质装置图:

(1)装置A中的反应方程式是________;g的作用________。
(2)装置B的作用_______;装置C中的试剂为________。
(3)装置E的现象________。
(4)装置F中的反应方程式是________ 。
(5)该装置的缺陷是________。
【答案】MnO2 +4HCl(浓)![]() MnCl2 +Cl2 ↑+2H2O 平衡压强,使液体顺利滴下 除去Cl2中的HCl 浓硫酸 湿润的有色布条褪色 Cl2+2KI=2KCl+I2 没有安装尾气处理装置
MnCl2 +Cl2 ↑+2H2O 平衡压强,使液体顺利滴下 除去Cl2中的HCl 浓硫酸 湿润的有色布条褪色 Cl2+2KI=2KCl+I2 没有安装尾气处理装置
【解析】
在装置A中MnO2与浓盐酸反应产生Cl2,由于浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl及水蒸气,通过B中饱和NaCl溶液除去HCl,通过C中的浓硫酸除去水蒸气,通过D、E验证具有漂白性的物质的成分,在F中Cl2与KI发生置换反应,产生I2使淀粉试纸变为蓝色,Cl2是大气污染物,在尾气排放前要进行尾气处理。
(1)装置A中MnO2与浓盐酸混合加热,发生氧化还原反应产生Cl2,反应的化学方程式是MnO2 +4HCl(浓)![]() MnCl2 +Cl2 ↑+2H2O;g将分液漏斗上下连接在一起,使液体上下气体压强相同,这样浓盐酸在重力作用下就可以顺利滴下,故g的作用是平衡压强,使液体顺利滴下;
MnCl2 +Cl2 ↑+2H2O;g将分液漏斗上下连接在一起,使液体上下气体压强相同,这样浓盐酸在重力作用下就可以顺利滴下,故g的作用是平衡压强,使液体顺利滴下;
(2)装置B的作用除去Cl2中的混合的杂质气体HCl;装置C的作用是干燥Cl2,其中的试剂为浓硫酸;
(3)D中干燥的纯净的氯气不能使干燥的有色布条褪色,而在装置E中,Cl2与布条上的水发生反应产生HCl、HClO,HClO具有强的氧化性,会将有色物质氧化为无色物质,因此观察到E中潮湿的有色布条褪色;
(4)由于氧化性Cl2>I2,所以在装置F中发生置换反应,反应方程式是Cl2+2KI=2KCl+I2;
(5)Cl2是有毒气体,直接排放会造成大气污染,所以该装置的缺陷没有安装尾气处理装置。