题目内容
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO+5I-+3H2O,下列说法不正确的是( )
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含有IO3- |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
D
解析试题分析:根据题意知,电解过程中左侧溶液变蓝色,说明左侧生成I2,左侧电极为电解池的阳极,电极反应为:2I--2e-=I2;右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧产生的OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,为保证两边溶液呈电中性,左侧产生的IO3-通过阴离子交换膜向右侧移动。A、根据上述分析知,右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-,正确;B、根据上述分析知,电解结束时,右侧溶液中含有IO,正确;C、根据上述分析知,电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑,正确;D、如果用阳离子交换膜代替阴离子交换膜,右侧电解产生的氢氧根不能通过阳离子交换膜进入左侧极区,电解槽内发生的总化学反应为2KI+2H2O
KIO3+3H2↑,正确;D、如果用阳离子交换膜代替阴离子交换膜,右侧电解产生的氢氧根不能通过阳离子交换膜进入左侧极区,电解槽内发生的总化学反应为2KI+2H2O 2KOH+I2+H2↑,错误。
2KOH+I2+H2↑,错误。
考点:考查电解原理的应用。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中会因化学腐蚀渐渐变暗 |
| B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
| C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀 |
| D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用 |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (CuCO3) | D.NaCl (NaOH) |
通过NOx传感器可监测NOx的含量,其工作原理示意图如下: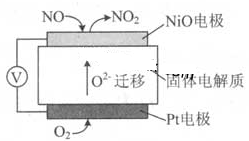
下列说法正确的是 ( )
| A.NiO 电极是该电池的正极 |
| B.Pt电极附近的pH 增大 |
| C.NiO 电极的电极反应式:NO—2e—+O2—=NO2 |
| D.固体电解质中O2-向正极移动 |
1966年美国福特汽车公司首次发表了Na-S电池的有关报导。其结构如图所示,电池反应为2Na+ S8
S8 Na2Sn。下列说法不正确的是
Na2Sn。下列说法不正确的是
| A.熔钠电极作电池的正极 |
| B.放电时Na+向正极移动 |
| C.充电时熔钠电极与电源的负极相连 |
| D.充电时阳极反应式为8Sn2-—16e-=nS8 |
如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是( )。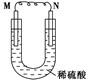
| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.是化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向是由M到N |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )
| A.在外电路中,电子从石墨电极流向银电极 |
| B.盐桥中的K+移向乙烧杯 |
| C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的
是( )
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。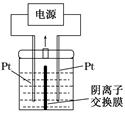
已知:3I2+6OH-=IO3-+5I-+3H2O
下列说法不正确的是( )
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束后,右侧溶液中含有IO3- |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |