题目内容
在下列实验过程中,出现的“异常”现象的解释,不正确的是
- A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为氢氧化铜的生成
- B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成
- C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐
- D.在氯化亚铁的溶液中,滴加氢氧化钠溶液 ,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化
A
试题分析:金属钠投入到硫酸铜溶液中,2Na+2H2O=2NaOH+H2↑,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2为蓝色沉淀物,而黑色沉淀物可能是CuS,故A错误。
考点:化学实验
点评:考查化学实验过程中的“异常”现象,属于易错题,应注意细心观察思考。
试题分析:金属钠投入到硫酸铜溶液中,2Na+2H2O=2NaOH+H2↑,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2为蓝色沉淀物,而黑色沉淀物可能是CuS,故A错误。
考点:化学实验
点评:考查化学实验过程中的“异常”现象,属于易错题,应注意细心观察思考。

练习册系列答案
相关题目
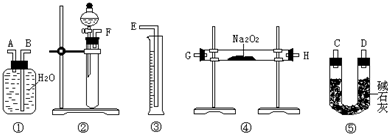

 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: