题目内容
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
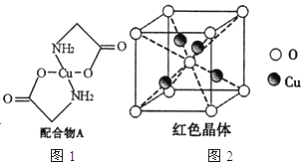
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
【答案】 3d104s1 N〉O〉C sp2、sp3 8 N2O(或SCN-、N3-等) Cu2O
【解析】(1)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为3d104s1,故答案为:3d104s1;
(2)同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以C、N、O三种元素的第一电离能由由小到大的排列顺序是N>O>C;故答案为:N>O>C;
(3)配合物A分子中一种碳有C=O,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化;故答案为:sp3、sp2;
(4)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键,所以1mol氨基乙酸钠中含有σ键的数目为8mol,故答案为:8;
(5)一个二氧化碳分子中原子个数为3个,价电子数为16,原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为:N2O(或SCN-、N3-等),故答案为:N2O(或SCN-、N3-等);
(6)利用均摊法知,该化合物中O原子个数=1+8×![]() =2,Cu原子个数=4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为:Cu2O,故答案为:Cu2O。
=2,Cu原子个数=4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为:Cu2O,故答案为:Cu2O。

 阅读快车系列答案
阅读快车系列答案