题目内容
已知蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
分析:化学反应中化学键断裂吸收能量,形成化学键放出能量,反应热等于反应物的总键能减生成物的总键能,以此解答该题.
解答:解:由化学键的键能可知H2(g)+Br2(g)=2HBr(g)△H=(436kJ/mol+200kJ/mol)-2×(369kJ/mol)=-102kJ/mol,因蒸发1mol Br2(l)需要吸收的能量为30kJ,则H2(g)+Br2(l)=2HBr(g)△H为=(-102kJ/mol)+(+30kJ/mol)=-72 kJ/mol,
故选B.
故选B.
点评:本题考查反应热的计算,题目难度不大,注意反应热与化学键的键能的关系,本题注意物质的聚集状态与反应热的大小比较,为易错点.

练习册系列答案
相关题目
已知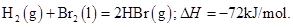 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBe(g) |
|
1mol分子中的化学键断裂需要吸收的热量/kJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200

 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表: 
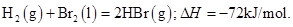 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
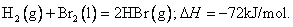 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表: