��Ŀ����
����Ŀ�������飨As)���ǵ�VA��Ԫ��, �������֪ʶ�ش��������⣺
(1)��֪���� 2O2(g) + N2(g)=N2O4(l) ��H1
�� N2(g)+2H2(g)=N2H4(l) ��H2
��O2(g)+2H2(g)=2H2O(g) ��H3
��2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H4=-1048.9kJ/mol
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4=______��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ_______��
(2)����Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ơ���д�������������γɵ������εĻ�ѧʽ_______��
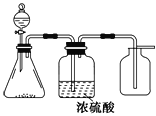
(3)������һ�ֳ��õĻ�ԭ���������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������lkg�������ɴ���_______Lˮ������ˮ���ܽ�O2��Ϊ10mg/L��
(4)������Ȼ������Ҫ��������ʽ�����ۻ�As4S4���ƻ�As2S3�ȣ����ڡ��ƻƿɱ�Ũ��������ΪH3AsO4��S,���ᱻ��ԭΪNO2,��Ӧ���������뻹ԭ�����ʵ���֮��Ϊ____________��
���𰸡� 2��H3-2��H2-��H1 ��Ӧ���ȶࡢ������������ N2H6(HSO4)2 ��N2H6SO4 ��(N2H5)2SO4 1��105 10:1
��������(1)��2O2(g)+N2(g)�TN2O4(l)��H1����N2(g)+2H2(g)�TN2H4(l)��H2����O2(g)+2H2(g)�T2H2O(g)��H3�������Ȼ�ѧ����ʽ��˹���ɣ�������2-����2-�ٵõ��ܣ�2N2H4(l)+N2O4(l)�T3N2(g)+4H2O(g)��H4=2��H3-2��H2-��H1�����ݷ�Ӧ�ܿ�֪��������N2O4��Ӧ�ų��������Ҳ����������壬��˿���Ϊ����ƽ������ʴ�Ϊ��2��H3-2��H2-��H1����Ӧ�����������������壻
(2)����Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백������������һ�����뷽��ʽΪN2H4+H2ON2H5++OH-���ڶ������뷽��ʽΪN2H5++H2ON2H62++OH-����������������γɵ�����N2H6(HSO4)2�� N2H6SO4��(N2H5)2SO4���ʴ�Ϊ��N2H6(HSO4)2�� N2H6SO4��(N2H5)2SO4��
(3)������һ�ֳ��õĻ�ԭ���������ڴ�����ѹ��¯ˮ�е���������������ʧ����N2H4��N2ʧȥ4e-��O2��O2-�õ�4e-��������������Ħ����������32g/mol����������������������ʵ�����ͬ��������1kg�������ɳ�ȥˮ���ܽ��O21kg�����Դ���ˮ�����Ϊ�� ![]() =1��105L���ʴ�Ϊ��1��105��
=1��105L���ʴ�Ϊ��1��105��
(4)1molAs2S3������ΪH3AsO4��Sʱת�Ƶ�����Ϊ[(5-3)��2+2��3]mol=10mol��1mol���ᱻ��ԭΪNO2ʱת�Ƶ���Ϊ(5-4)mol=1mol�����ݵ�ʧ�����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ10��1���ʴ�Ϊ��10��1��