题目内容
25 ℃时,合成氨反应的热化学方程式为:
N2 (g) +3H2 (g) 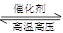 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A.混合气体的质量不变时,说明该反应一定达到平衡状态
B.将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C.催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D.在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
【答案】
D?
【解析】A.不管是反应物还是生成物,都是气体,所以说,无论是否达到平衡,混合气体的质量都不变。
B.将容器的体积扩大到原来的二倍,反应物、生成物浓度均减小,因此υ(正)、υ(逆)均较小,平衡向左移动
C.催化剂既不能提高N2的转化率,但能缩短达到平衡所需时间,提高生产效益
D.由于此反应时可逆反应,在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
