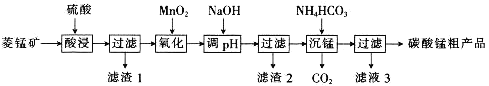
题目内容
【题目】H3BO3(一元弱酸) 可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
D. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
【答案】C
【解析】A 、左边石墨电极为电解池的阳极,M室中的H2O失去电子生成氧气,电极方程式为:2H2O-4e-= O2↑+4H+,A正确;B、右边石墨电极为阴极,水中的H+得到电子生成H2,溶液中的OH-浓度增大,原料室中的Na+通过c膜移向N室,所以N室中NaOH的浓度增大,故N室中:a% <b%,B正确;C、M室中生成的H+通过a膜进入产品室,原料室中的B(OH)4-通过b膜进入产品室,发生反应:H++ B(OH)4-=H3BO3+H2O。生成1mol H3BO3,需要从M室中产生1molH+,则电路中转移的电子为1mol,阴极室产生的是H2,根据电子守恒可知阴极室产生的H2的物质的量为0.5mol,其在标准状况下的体积为11.2L,C错误;D、M室中产生的H+通过a膜进入产品室,a膜为阳膜,原料室中的B(OH)4-通过b膜进入产品室,b膜为阴膜,两者在产品室发生反应:H++ B(OH)4-=H3BO3+H2O,反应的原理为强酸制取弱酸,D正确。正确答案为C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目