题目内容
在如图所示两个装置中,溶液体积均为200mL,开始时电解质溶液浓度均为0.11mol/L,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐类的水解和溶液体积的变化,试求:
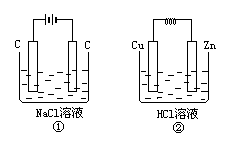
(1)两装置产生的气体在标准状况下所占体积各为多少升?
(2)两装置中反应后的pH各为多少?
答案:
解析:
提示:
解析:
|
(1)①中气体总体积为0.448L,②中气体体积为0.224L;(2)①中pH为13,②中pH为2 【巧解导析】装置①为电解池,用惰性电极电解NaCl溶液,类似氯碱工业,其电解方程式为:2NaCl+2H2O 装置②为原电池,其电池反应为Zn+2H+=Zn2++H2~2e-,电路中通过0.02mol电子时,消耗H+ 0.02mol,则反应后溶液中H+浓度为0.11- |
提示:
|
【巧解点悟】解题关键点:能准确书写电解反应方程式和电池反应方程式,找出已知量与未知量之间关系列式求解.易错点:不能找出H+浓度(或OH-)同电路中通过的电子之间的关系,将pH算错. |

练习册系列答案
相关题目
 2NaOH+H2↑+Cl2↑~2e-,当电路中通过0.02mol电子时,生成n(NaOH)=0.02mol,忽略Cl2溶于水对NaOH的影响,溶液中c(OH-)=
2NaOH+H2↑+Cl2↑~2e-,当电路中通过0.02mol电子时,生成n(NaOH)=0.02mol,忽略Cl2溶于水对NaOH的影响,溶液中c(OH-)=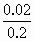 =0.1mol/L,得c(H+)=10-13mol/L,pH=13,生成H2和Cl2总体积为0.02×22.4=0.448L.
=0.1mol/L,得c(H+)=10-13mol/L,pH=13,生成H2和Cl2总体积为0.02×22.4=0.448L.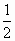 ×22.4=0.224L.
×22.4=0.224L.

 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)