题目内容
【题目】若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则m g Na与氧气反应,生成固体的质量可能为
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.8)g
A. 仅①④ B. 仅①⑤ C. 仅③④ D. 仅①②③④
【答案】D
【解析】钠在氯气中燃烧生成氯化钠,根据题意可知,参加反应的氯气质量是3.55g,物质的量是![]() =0.05mol,反应中氯气得到电子的物质的量是0.05mol×2=0.1mol。则根据电子得失守恒可知m g钠在反应中失去0.1mol电子。如果mg钠与氧气反应完全转化为氧化钠,则需要氧气的物质的量是
=0.05mol,反应中氯气得到电子的物质的量是0.05mol×2=0.1mol。则根据电子得失守恒可知m g钠在反应中失去0.1mol电子。如果mg钠与氧气反应完全转化为氧化钠,则需要氧气的物质的量是![]() =0.025mol,质量是0.025mol×32g/mol=0.8g,即反应后生成固体的质量是m+0.8 g;如果反应中钠完全转化为过氧化钠,则需要氧气的物质的量是
=0.025mol,质量是0.025mol×32g/mol=0.8g,即反应后生成固体的质量是m+0.8 g;如果反应中钠完全转化为过氧化钠,则需要氧气的物质的量是![]() =0.05mol,质量是0.05mol×32g/mol=1.6g,因此反应后生成固体的质量是(m+1.6) g;如果反应中既有氧化钠,也有过氧化钠生成,则反应后生成固体的质量一定介于(m+0.8 )g和(m+1.6) g之间,所以①②③④均有可能,D正确;答案选D。
=0.05mol,质量是0.05mol×32g/mol=1.6g,因此反应后生成固体的质量是(m+1.6) g;如果反应中既有氧化钠,也有过氧化钠生成,则反应后生成固体的质量一定介于(m+0.8 )g和(m+1.6) g之间,所以①②③④均有可能,D正确;答案选D。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案【题目】另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
(1)步骤一:电解精制:电解时,粗铜应与电源的极相连.阴极上的电极反应式为 .
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: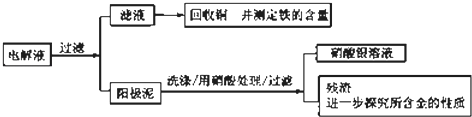
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: , 残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <<1 |
2 | Au3++4Cl﹣AuCl4- | >>1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 .
②滤液含量的测定:以下是该小组探究滤液的一个实验流程.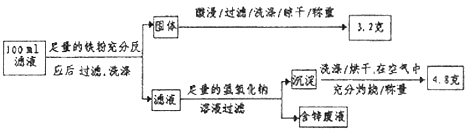
则100mL滤液中Cu2+的浓度为 molL﹣1 , Fe2+的浓度为 molL﹣1 .