题目内容
下列对N、O、P、S相关性质比较正确的是( )
| A、酸性:H3PO4>HNO3 |
| B、原子半径:S>P |
| C、具有的可变化合价数:N>O |
| D、稳定性:H2S>H2O |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A.元素非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.同周期元素从左到右原子半径逐渐减小;
C.根据O元素和N元素的化合价分析;
D.元素非金属性越强,对应的氢化物越稳定.
B.同周期元素从左到右原子半径逐渐减小;
C.根据O元素和N元素的化合价分析;
D.元素非金属性越强,对应的氢化物越稳定.
解答:
解:A.非金属性N>P,元素非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H3PO4<HNO3,故A错误;
B.同周期元素从左到右原子半径逐渐减小,原子半径P>S,故B错误;
C.O元素的化合价常见的有0、-1、-2,N的化合价常见的有-3、0、+1、+2、+3、+4、+5,所以具有的可变化合价数:N>O,故C正确;
D.非金属性O>S,元素非金属性越强,对应的氢化物越稳定,则稳定性:H2S<H2O,故D错误.
故选C.
B.同周期元素从左到右原子半径逐渐减小,原子半径P>S,故B错误;
C.O元素的化合价常见的有0、-1、-2,N的化合价常见的有-3、0、+1、+2、+3、+4、+5,所以具有的可变化合价数:N>O,故C正确;
D.非金属性O>S,元素非金属性越强,对应的氢化物越稳定,则稳定性:H2S<H2O,故D错误.
故选C.
点评:本题考查元素周期律的递变规律,题目难度不大,注意把握元素周期律的递变规律以及元素的性质与对应单质、化合物的性质的关系.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
美国亚利桑那州大学(ASU)和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为:2H2O(g)
2H2(g)+O2(g).有关该反应的说法正确的是( )
| ||
| 人造树叶 |
| A、△H<0 |
| B、△S<0 |
| C、化学能转变为电能 |
| D、氢能是理想的绿色能源 |
将金属钠投入AlCl3溶液中,下列有关叙述一定正确的是( )
| A、有气体生成,最后一定有白色沉淀 |
| B、一定无气体生成 |
| C、溶液最后澄清且有气体放出 |
| D、一定有气体生成 |
C7H16的所有同分异构体中,分子中含有四个甲基的有( )
| A、4种 | B、5种 | C、7种 | D、8种 |
下列元素中,属于非金属元素的是( )
| A、Ca | B、C | C、Na | D、Al |
下列说法中正确的是( )
| A、硫酸的摩尔质量是98g |
| B、摩尔是物质质量的单位 |
| C、氮原子的质量就是氮的相对原子质量 |
| D、氧气的摩尔质量(单位:g?mol-1)在数值上等于它的相对分子质量 |
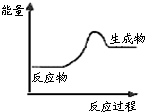 根据如图提供的信息,下列所得结论不正确的是( )
根据如图提供的信息,下列所得结论不正确的是( )| A、该反应为放热反应 |
| B、该反应一定有能量转化成了化学能 |
| C、反应物比生成物稳定 |
| D、因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |