题目内容
已知:①Al(OH)3的电离方程式为为H++PbSO4+2CH3COONa====Na2SO4+(CH3COO)2Pb下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法正确的是( )
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
D
解析:由①知Al(OH)3为弱电解质;由②知AlCl3为共价化合物,属电解质;由③知(CH3COO)2Pb为弱电解质,综合判断可知答案为D。

(15分)我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下:
已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、 (填离子符号);
(2)调节PH应最好使用 ;
| A.Fe | B.Ca(OH)2 | C.NH3?H2O | D.NaOH |
(4)步骤②中发生的化学反应方程式为: ;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入 处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至 ,记录消耗KMnO4溶液的体积为V mL;此时发
 生的反应为:
生的反应为:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为3
 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。 阅读下表中短周期主族元素的相关信息。
|
元素代号 |
相关信息 |
|
A |
A的单质能与冷水剧烈反应,得到强碱性溶液 |
|
B |
B的原子最外层电子数是其内层电子数的三倍 |
|
C |
在第3周期元素中,C的简单离子半径最小 |
|
D |
A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
|
E |
所有有机物中都含有E元素 |
请回答:(1)、在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提供能源。写出该原电池正极的电极反应式 。
(2)、用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
其中,阴极产物是
(3)、常温下,0.1 mol·L-1X溶液的pH 7(填“>”、“=”或“<”),原因是 (用离子方程式说明)。
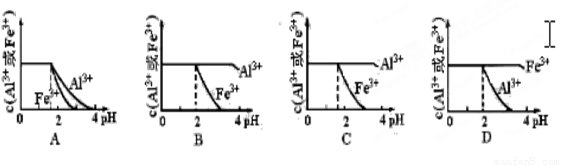
(4)、已知Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
(填字母代号)。