题目内容
铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
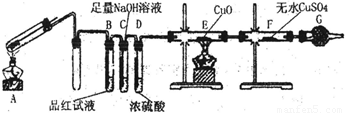
(1)证明反应所产生的气体中有SO2生成的现象是 。
(2)证明气体中含有氢气的实验现象是 。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
|
实验操作 |
预期现象 |
结论 |
|
取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 |
|
|
|
步骤②:往b试管中滴入 。 |
|
溶液含有Fe3+ |
(16分)(1)品红试液变浅(或褪色) (2分)
(2)E中黑色(CuO)变成红色,F中白色粉末(CuSO4)变成蓝色;(2分)
(3)假设3:溶液中铁元素只有Fe2+ (2分)
【实验探究】
|
实验操作 |
预期现象 |
结论 |
|
取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入少量(1分)0.01mol/L酸性KMnO4溶液(1分)。 |
KMnO4溶液的紫红色褪去(或变浅)(2分) |
溶液含有Fe2+(2分) |
|
步骤②:往b试管中滴入几滴(1分)KSCN溶液,充分振荡(1分)[或几滴(或少量)0.1mol/LKI溶液和淀粉溶液(1分)] 。 |
溶液变为血红色(2分) [或溶液变为蓝色(2分)] |
溶液含有Fe3+ |
【解析】
试题分析:(1)SO2具有漂白性、酸性、还原性和氧化性,读图可知,该实验用品红溶液检验是否有SO2生成,若品红溶液褪色或变浅,说明装置A中反应产生的气体含有SO2;(2)氢气具有强还原性,在加热条件下能使黑色的氧化铜还原为红色的单质铜,H2被氧化为能使白色的无水CuSO4固体变蓝的H2O,若装置E中黑色固体变为红色,F中白色粉末变为蓝色,说明装置A中放出的气体中含有H2;(3)常温下铁被浓硫酸钝化,表面有一层致密氧化物薄膜,加热下强氧化性、强酸性的浓硫酸可以将铁氧化为铁盐,而过量的单质铁可以将铁盐还原为亚铁盐,因此反应后A的溶液中铁元素可能既有Fe2+又有Fe3+,也可能只有Fe3+,还可能只有Fe2+,根据已知假设1、假设2的信息推断假设3为溶液中铁元素只有Fe2+;根据铁及其化合物的性质可知,Fe2+具有还原性,能使酸性KMnO4溶液褪色,Fe3+具有氧化性,能将KI溶液还原为能使淀粉溶液变蓝的I2,Fe2+遇KSCN溶液不变红,而Fe3+遇KSCN溶液变红,大量含有Fe3+的溶液呈黄色,与溴水的颜色相同,由此可以选择适当的试剂设计实验方案验证A的溶液中既有Fe2+又有Fe3+。
考点:考查实验方案的设计,涉及元素化合物的性质、气体的检验方法、提出假设、设计实验方案验证假设等知识。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
![]() 提出猜想
提出猜想
![]() Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
![]() Ⅱ.所得气体中可能含有 ▲ 中的一种或两种。
Ⅱ.所得气体中可能含有 ▲ 中的一种或两种。
![]() 实验探究
实验探究
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 | ▲ | ▲ |
| 步骤②: ▲ | ▲ | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | ▲ | 含有两种气体 |

(8分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
【提出猜想】
猜想一:所得气体中可能是SO2。
猜想二:所得气体中可能是 。
猜想三:所得气体中可能是 的混合气体。
【实验探究】
(1)将所得气体通入如下装置
 |
证明猜想三正确的实验现象 ;
(2)点燃试管中的气体前,必须要进行的操作是 。
(15分)
纯铁在冷的浓硫酸中能发生钝化。某兴趣小组同学发现将一定量的纯铁与浓硫酸加热时,铁完全溶解,得到溶液A,并产生大量气体B。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
Ⅲ.任意写出一个铁与浓硫酸加热时,可能发生的有关反应方程式
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ[来源:Z&xx&k.Com] |
步骤①:取少量溶液A,滴入0.01 mol/L 酸性KMnO4溶液 |
[来源:学&科&网Z&X&X&K] |
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体B通入如下图装置 |
|
含有两种气体 |

[问题讨论]
有同学提出,若另外选用KSCN溶液,则
仅利用KSCN和H2O2两种溶液即可完成
猜想Ⅰ的所有探究,请对该观点进行评价:
。
 (2010?揭阳模拟)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
(2010?揭阳模拟)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分. 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.