题目内容
【题目】若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B. 常温常压下,18 mL水中所含氢离子数约为10-7NA
C. 标准状况下,22.4 L氦气中含有的原子数约为NA
D. 23 g组成为C2H6O的有机物,C—H键数目为3NA
【答案】C
【解析】A项阴离子总数等于0.1mol,错误;B项所含氢离子数目小于10-7NA,错误;C项,氦为单原子分子,所以原子数为NA;D项C2H6O存在同分异构体,错误。答案选C。

练习册系列答案
相关题目
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
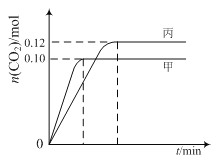
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%