题目内容
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 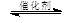 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
|
投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
(12分)(1)CH4(g) +2NO2(g)=N2(g) +CO2(g) +2H2O(g) △H=-867 kJ·mol-1(3分)
(2)①减小(2分) 不变(2分) ②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(3分) ③9.6(2分)
【解析】
试题分析:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的。则两式相加,可得反应2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g),所以反应热△H=-574 kJ/mol--1160 kJ/mol=-1734 kJ/mol 。
(2)①根据表中数据可知,随着温度的升高,CO2的转化率是减小的,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。升高温度平衡常数减小。温度不变,提高投料比[n(H2) / n(CO2)],CO2的转化率增大。但平衡常数只与温度有关系,因此平衡常数是不变的。
②原电池中负极失去电子,所以甲醚在负极通入。由于电解质是碱性的,则负极的电极反应式是CH3OCH3 -12e- +16OH-=2CO32- +11H2O。通电30s后成反应的甲醚是1.12 L·min-1×0.5min=0.56L,物质的量是0.56L÷22.4L/mol=0.025mol,因此根据电极反应式可知转移电子的物质的量是0.025mol×12=0.3mol。阴极是铜离子得到电子,电极反应式是Cu2++2e-=Cu,所以生成的铜是0.3mol÷2=0.15mol,质量是0.15mol×64g/mol=9.6g。
考点:考查盖斯定律的应用、外界条件对平衡状态以及平衡常数的影响、电化学原理的应用和计算
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,基础性强,有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学习效率。也有利于培养学生的逻辑推理能力和抽象思维能力。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
(10分)燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 ▲ 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) + 6H2(g)  CH3OCH3(g)
+ 3H2O(g)
CH3OCH3(g)
+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时, CO2的转化率见下表:
|
投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37%[ |
22% |
①若温度升高,则反应的平衡常数K将 ▲ (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 ▲ 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 ▲ 。
③在②所确定的电池中,若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 ▲ g。
 (2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等. 、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。

 。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的
。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的 ________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。
________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。